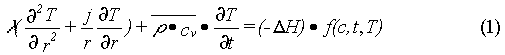PROTEOSTAT® Thermal shift stability assay kit
加速蛋白稳定性筛选
- 产品特性
- 相关资料
- Q&A
- 参考文献

PROTEOSTAT® Thermal shift stability assay kit
加速蛋白稳定性筛选
● 简单、灵敏、均相的荧光检测,无需分离或稀释样品
● 可用于加速优化蛋白稳定性条件
● 无需了解蛋白功能或配体结合位点,也可进行配体结合检测
● 可在较广的温度、pH值和离子强度范围内使用,与常用的缓冲液和辅料兼容
● 为采用多种仪器进行交叉验证提供一种方便、互补的正交方法
PROTEOSTAT® Thermal shift 稳定性检测试剂盒内含有一种检测蛋白聚集的荧光染料,因此可用于监测系统热应力条件下的蛋白稳定性。通过 Thermal shift 分析,可轻松确定大部分蛋白的聚集温度。聚集温度是蛋白稳定性的指标,可用于优化使蛋白聚集最小化的条件,以及鉴定与目标蛋白结合并赋予结构稳定性的配体。配合使用相关的 PROTEOSTAT® 蛋白复性和聚集敏感试剂盒(产品编号:ENZ-51040)可确定合适的蛋白复性条件。增加聚集温度的优化条件可使蛋白的稳定性有所提升。

图1. 利用PROTEOSTAT® Thermal shift 稳定性检测试剂盒分析山羊抗小鼠 IgG(pH=7.4,11.2 mg/mL)的典型结果。
图1. 使用 RT-PCR 仪器,以 3°C/min 的速率将温度从30°C升至99°C,同时连续读取荧光值。蓝线表示原始荧光强度数据,红线表示对应的一阶导
图1. 数曲线,代表荧光强度曲线的斜率。通过一阶导数图,可得出蛋白的聚集温度(Tagg:斜率最大点)。
PROTEOSTAT® 染料的 Tagg 值不同于 SYPRO® Orange 染料的 Tm 值
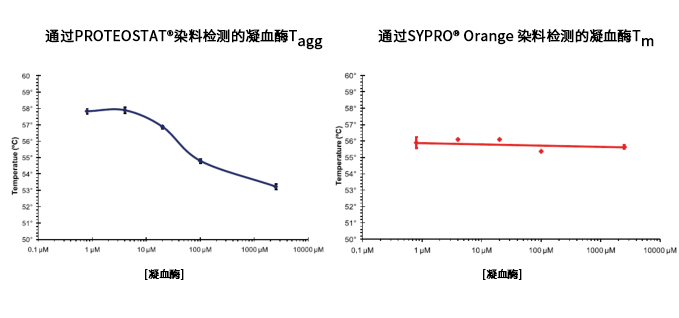
图2. PROTEOSTAT® 染料所得得聚集温度不同于使用 SYPRO® Orange 染料获得的熔解温度。
图2. SYPRO® Orange 染料是一种环境敏感染料,能够与未折叠蛋白的疏水区结合,用于测量 Tm。Tm 是 Thermal shift 曲线的温度中点,在温度
图2. 中点 Tm 时,样品中的目标蛋白一半呈现出解折叠状态,而另一半保持折叠状态。解折叠不依赖于相邻蛋白。PROTEOSTAT 是一种分子转子染
图2. 料,可与蛋白质聚集体的表面结合。Tagg 是热聚集曲线的中点。蛋白解折叠后开始聚集,聚集取决于相邻蛋白。蛋白浓度越高,聚集的趋势越
图2. 大。
◆产品详情
|
特点 |
本试剂盒用于监测系统热应力条件下的蛋白稳定性。 |
|
品质保证 |
每批次 PROTEOSTAT®Thermal shift 稳定性检测试剂盒的样品试剂盒均已按照操作手册中的步骤进行测试。 16 μg/ml β-乳球蛋白的聚集温度单峰位于76°±2°C处。 |
|
使用/稳定性 |
在产品标签注明的日期前,试剂盒组分在适当的储存条件下可稳定保存。 |
|
可存放于-20°C的无霜冰箱中。 |
|
|
储存条件 |
避光。避免反复冻融。 |
|
运输方式 |
干冰运输 |
|
储存温度 |
-20°C |
|
组分 |
· PROTEOSTAT® TS 检测试剂 · β-乳球蛋白对照 · 10X 检测缓冲液 |
|
技术信息/产品说明 |
应用说明: Prediction of Aggregation Propensity and Monitoring of Aggregation of Antibody-Drug Conjugates (ADC) using ProteoStat® Reagents 检测样本: PROTEOSTAT® Cited Samples
Enzo及PROTEOSTAT均为Enzo Life Sciences, Inc. 的商标。Grenier为Grenier Bio-One 的注册商标。Enzo的部分产品和产品应用受美国、外国专利以及正在申请的专利的保护。本产品由ENZO LIFE SCIENCES, INC. 制造和销售,仅供研究市场的终端用户作研究使用,不得用于诊断或治疗用途。购买行为不包括在商业上使用、开发或以其他方式利用本产品的任何权利或许可。未经ENZO LIFE SCIENCES, INC. 事先明确书面授权,严禁对本产品进行任何商业用途、开发或利用,或使用本产品进行研发。 |
|
监管状态 |
RUO – 仅供研究使用 |
◆产品列表
|
产品编号 |
产品名称 |
包装 |
|
ENZ-51027-K400 |
PROTEOSTAT® Thermal shift stability assay kit |
400 tests |
|
ENZ-51027-K100 |
100 tests |
产品参考文献
|
1. |
Constructive approach for synthesis of a functional IgG using a reconstituted cell-free protein synthesis system: S. Murakami, et al.; Sci. Rep. 9, 671 (2019), Application(s): Purified IgG or Trastuzumab, 摘要; 全文 |
|
2. |
Structural insights into humanization of anti-tissue factor antibody 10H10: A. Teplyakov, et al.; MAbs. 10, 269 (2018), Application(s): Monoclonal antibodies, 摘要; 全文 |
|
3. |
Protein catalyzed capture agents with tailored performance for in vitro and in vivo applications: M.B. Coppock, et al.; Biopolymers 108, e22934 (2017), Application(s): Stability of peptide-based ligands, 摘要; |
|
4. |
Time-Dependent Protein Thermostability Assay: I. Vandecaetsbeek, et al.; Methods Mol. Biol. 1377, 79 (2016), 摘要; |
|
5. |
Effect of Polyethylene Glycol Conjugation on Conformational and Colloidal Stability of a Monoclonal Antibody Antigen-Binding Fragment (Fab'): C. Roque, et al.; Mol. Pharm. 12, 562 (2015), 摘要; |
|
6. |
Modulating the thermostability of Endoglucanase I from Trichoderma reesei using computational approaches: G. Bayram Akcapinar, et al.; Protein Eng. Des. Sel. 28, 127 (2015), 摘要; |
|
7. |
Site-specific conjugation of monomethyl auristatin E to anti-CD30 antibodies improves their pharmacokinetics and therapeutic index in rodent models: F. Lhospice, et al.; Mol. Pharm. 12, 1863 (2015), 摘要; |
|
8. |
A general approach to antibody thermostabilization: A.D. McConnell, et al.; MAbs 6, 1274 (2014), Application(s): Stability of antibodies, 摘要; 全文 |
|
9. |
Modifications of cysteine residues in the transmembrane and cytoplasmic domains of a recombinant hemagglutinin protein prevents cross-linked multimer formation and potency loss: K.M. Holtz, et al.; BMC Biotechnol. 14, 111 (2014), 摘要; |
|
10. |
An integrated approach to extreme thermostabilization and affinity maturation of an antibody: A.D. McConnell, et al.; Protein Eng. Des. Sel. 26, 151 (2013), 摘要; |
|
11. |
Mouse, but not human STING, binds and signals in response to the vascular disrupting agent 5,6-dimethylxanthenone-4-acetic acid: J. Conlon, et al.; J. Immunol. 190, 5216 (2013), 摘要; |
|
12. |
Optimization of protein purification and characterization using Thermofluor screens: S. Boivin, et al.; Protein Expr. Purif. 91, 192 (2013), (Review), 摘要; |
|
13. |
Protein quality control acts on folding intermediates to shape the effects of mutations on organismal fitness: S. Bershtein, et al.; Mol. Cell 49, 133 (2013), Application(s): Aggregation propensity of the DHFR proteins, 摘要; |
|
其他参考文献 |
|
|
1. |
Estimation of protein aggregation propensity with a melting point apparatus: A.A. Raibekas; Anal. Biochem. 380, 331 (2008), 摘要; |
|
2. |
Thermofluor-based high-throughput stability optimization of proteins for structural studies: U.B. Ericsson, et al.; Anal. Biochem. 357, 289 (2006), 摘要; |
|
3. |
Structure of the cross-beta spine of amyloid-like fibrils: R. Nelson, et al.; Nature 435, 773 (2005), 摘要; |
|
4. |
Study of the thermal denaturation of ribonuclease A by differential thermal analysis and susceptibility to proteolysis: B.G. Winchester, et al.; Biochem J. 117, 299 (1970), 摘要; |