上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
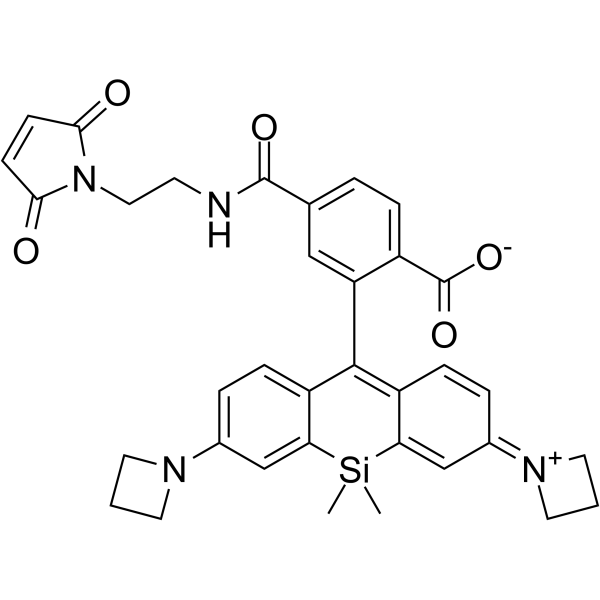
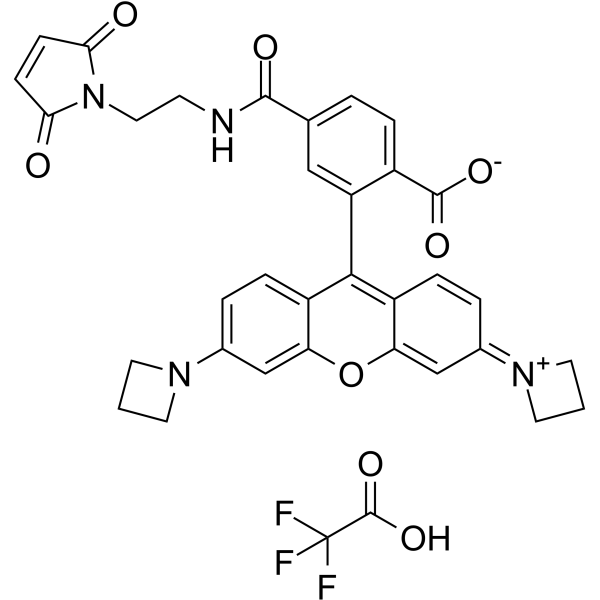
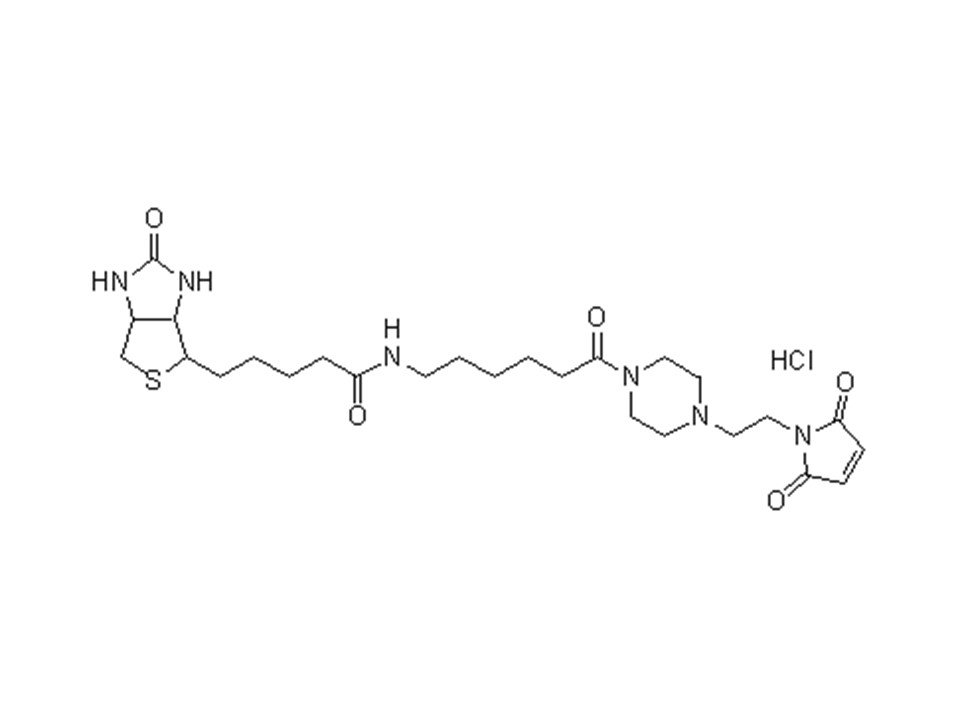
C26H41ClN6O5S
585.16

试剂盒内含

规格性状
性状:该产品为白色至微黄色粉末,溶于二甲基亚砜。
纯度(HPLC):90.0%以上
二甲基亚砜可溶:测试合格
产品概述
已知生物素与抗生物素蛋白牢固结合,其特性已广泛用于高灵敏度分析。由于生物素与抗生物素蛋白之间的结合稳定性常数为1015,比抗原-抗体反应高3至4个数量级,因此一旦结合至抗生物素蛋白的生物素在生理条件下不会脱落。另外,生物素是具有羧基的小分子,可以容易地化学修饰,并且可以在不损害蛋白质等的活性的情况下进行标记。因此,已经开发出许多生物素化合物作为使用抗体进行免疫测定的标记剂。具有活性酯基的生物素通常用于与蛋白质的氨基(NH2基)结合,具有马来酰亚胺基的生物素用于巯基(SH基)。
根据目的,有必要选择在抗生物素蛋白识别的生物素头和反应性基团之间的间隔物的长度,但是通常,间隔物越长,当抗生物素蛋白结合时,对抗体的抗原识别活性越强。可以认为,间隔物的影响可能引起非特异性吸附,并且在测量期间的背景可能很高。因此,为了提高测量灵敏度,请查看S/N(信噪比)。必须选择适当长度的垫片。
间隔基通常使用氨基己酸,并且存在一种化合物,其中一个分子的氨基己酸通过酰胺键被引入生物素中,并且该化合物中的两个分子被引入。由于己酸间隔物变长,水溶性变差,因此通常将生物素标记试剂溶解在DMSO中并添加到含有蛋白质的缓冲液中的方法是普遍的。
当在用氨基标记蛋白质时不能使用有机溶剂时,可以使用具有磺酸基的活性酯化合物。此外,在与巯基的反应中,以相同的方式使用由DMSO制备的溶液,但是由于其在间隔部分具有哌嗪结构,因此通过质子化在中性区域显示水溶性。
用于还原糖的生物素酰肼化合物的水溶性低,需要在DMSO溶液中进行调节。
在ELISA(酶联免疫吸附测定)中,将酶标记的链霉亲和素与生物素标记的抗体结合的方法是常见的。与抗生蛋白链菌素相比,抗生物素蛋白便宜,但很少用于ELISA中。原因是背景极高,并且认为高PI是原因。抗生物素蛋白通常用于通过柱分离生物素结合蛋白等的目的。
原理
操作步骤
产品使用步骤:
1. 制备含巯基的抗体
1) 用PBS溶解DTT (浓度为200mmol/l),制成DTT溶液。
2) 精确称量1.0-5.0mg抗体并记录,加入500ul 10mmol/l HEPES Buffer (pH8.0) 溶解蛋白质,制成抗体溶液。
3) 在抗体溶液加入2ul DTT溶液,充分混合。
2. 凝胶过滤纯化
1) 打开NAP-5层析柱上的盖子,弃去填充液。
2) 打开层析柱出口的盖子,用PBS分数次洗脱,每根层析柱收集大约10ml的洗脱液,使凝胶平衡。
3) 用移液器吸取500μl标记好的抗体溶液加入到层析柱中,弃去此时的流出液。
4) 在层析柱的出口处放置一根管子,在层析柱中加入1mlPBS,收集流出的抗体。
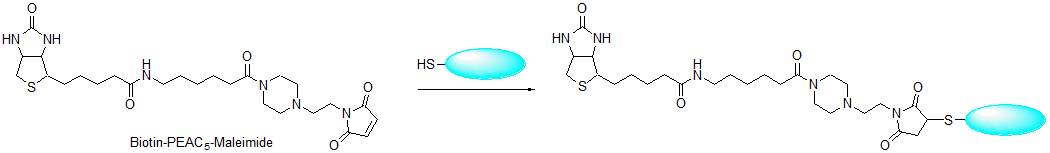
3. 生物素标记
1) 用DMSO溶解Biotin-PE-maleimide (浓度为50mmol/l,4.7mg/200ul或10mg/424ul)。
*用Biotin-PEAC5-maleimide时浓度为5.9mg/200ul或10mg/342ul。
2) 在纯化好的抗体溶液中加入配制好的生物素标记试剂溶液,抗体:生物素标记试剂的混合摩尔比为1:10左右。
3) 充分混合后,在水浴恒温摇床 (25℃)中过夜培养。
4. 标记抗体的凝胶过滤纯化
1) 打开NAP-10层析柱上的盖子,弃去填充液。
2) 打开层析柱出口的盖子,用PBS分数次洗脱,每根层析柱收集大约15ml的洗脱液,使凝胶平衡。
3) 用移液器吸取1ml标记好的抗体溶液加入到层析柱中,弃去此时的流出液。
4) 在层析柱的出口处放置一根管子,在层析柱中加入1.5ml PBS,收集流出的生物素标记抗体。
参考文献
1) S. Hashida, M. Imagawa, S. Inoue, K. H. Ruan and E. Ishikawa , “Mor Useful Maleimide Compounds for the Conjugation of Fab’ to Horseradish Peroxidase throuth Thiol Groups in the Hinge”, J. Appl. Biochem., 1984, 6, 56.
2) E. Ishikawa, M. Imagawa, S. Hashida, S. Toshitake, Y. Hamaguchi and T. Ueno, “Enzyme-labeling of Antibodies and their Fragments for Enzyme Immunoassay and Immunohistochemical Staining”, J. Immunoassay, 1983, 4, 209.
3) H. -J. Friesen, P. Hermentin and P. Gronski, “Novel Maleimido-Biotins for the Selective Biotinylation of Sulfhydrils”, Protides Biol. Fluids, 1987, 34, 43.
4) E. Ishikawa, S. Hashida, T. Kohno, T. Kotani and S. Ohtani, “Modification of Monoclonal Antibodies with Enzymes, Biotin, and Fluorochromes and Their Applications”, Immunol. Ser., 1987, 33, 113.
5) R. B. del Rosalio and R. L. Wahl, “Disulfide Bond-targeted Radiolabeling : Tumor Specificity of a Streptavidine-biotinylated Monoclonal Antibody Complex”, Cancer Res. (Suppl.), 1990, 50, 804S.