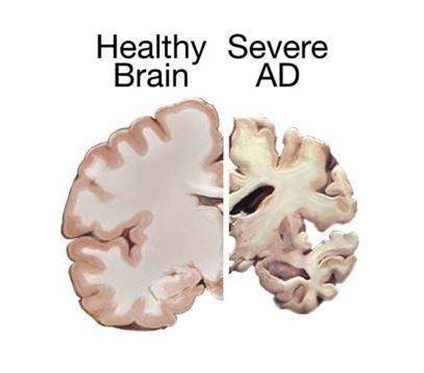
阿尔兹海默病(Alzheimer’s Disease)是痴呆症最常见的进展形式,属于典型的晚发型疾病,95%的发病年龄在60岁以上。其特征主要是含有β淀粉样蛋白的神经炎斑块,和神经纤维缠结含有过度磷酸化的Tau蛋白聚集物。其检测依据主要是脑皮质萎缩神经影像学表现、18F-脱氧核糖葡萄糖正电子扫描,以及脑脊液中β淀粉样蛋白和总tau蛋白或磷酸化tau蛋白的测量。
阿尔兹海默病的发生,与家族遗传、疾病史和生活方式等因素有关,大约25%的阿尔兹海默病病例是由于家族遗传原因导致的。目前也发现多种易感基因增加了疾病发展的风险,例如APOE基因具有三种等位变异,即e2,e3和e4,它们编码不同的蛋白质异构体,APOE e4等位基因的杂合子或纯合子的存在增加了发病的风险。其它与早发性阿尔兹海默病相关的基因包括APP,PSEN1和PSEN2。其它增加迟发性阿尔兹海默病发病风险的基因有ABCA7,AKAP9, BIN1, CASS4, CD2AP, CD33, CLU, EPHA1, FERMT2, HLA-DRB5/DRB1, INPP5D, MEF2C, MS4A6A/MS4A4E, PICALM, PLD3, PTK2B, SORL1, TREM2和UNC5C。
阿尔兹海默病的发病机制被归因于大脑皮层和边缘神经元中β淀粉样蛋白和细胞内高磷酸化微管相关蛋白聚集物(Tau聚集物)在细胞外的积累[1]。淀粉样蛋白积累发生于γ分泌酶和BACE1对淀粉样蛋白前体蛋白(APP)的改变切割,以产生不溶性Aβ纤维。这些原纤维聚集,进入突触间隙,干扰突触信号,并聚合成斑块。聚合激活激酶,导致Tau蛋白的过度磷酸化和聚合成神经纤维缠结。斑块和缠结的积累触发了小胶质细胞的激活和局部炎症反应[2]。神经纤维缠结(NFTs)是微管相关-protein (Tau)过度磷酸化的结果。蛋白与微管蛋白共同组装形成成熟的微管。当Aβ纤维在细胞微环境中积累时,释放的激酶会使-protein过度磷酸化,导致其寡聚并聚集成NFTs。这些神经元胞质内高度不溶性的NFTs积累导致神经元之间通讯的丢失,最终导致细胞凋亡。其他激酶也参与蛋白的磷酸化或APP的加工,包括GSK3β,CDK5,蛋白激酶C,蛋白激酶A,ERK2,caspase 3和caspase 9。此外,参与蛋白过磷酸化的其他激酶包括MAPK,ERK1,MEK,MARK,JNKs,p38和PKA。斑块形成过程中的小胶质细胞浸润也被证明会加剧阿尔兹海默病的发病。细胞外和细胞内的斑块和NFTs引起毒性和小胶质细胞浸润以及促炎细胞因子和趋化因子的释放,触发斑块区域的免疫反应。其他与阿尔兹海默病相关的基因包括早老素(PSEN1和PSEN2),它们属于γ-分泌酶家族,其突变与早发性阿尔兹海默病相关。除此之外,G蛋白偶联受体(GPCRs)家族已被确定参与中枢神经系统疾病和阿尔兹海默病[3]。GPCRs是一个膜蛋白超家族,包括5个不同的家族成员,即rhodopsin (a家族)、secretin (B家族)、glutamate (C家族)、adhesion(粘连)和Frizzled/Taste2。GPCRs参与了阿尔兹海默病的发病机制,并被证明与BACE1和γ分泌酶结合,这两种酶都参与了APP的水解处理[4]。
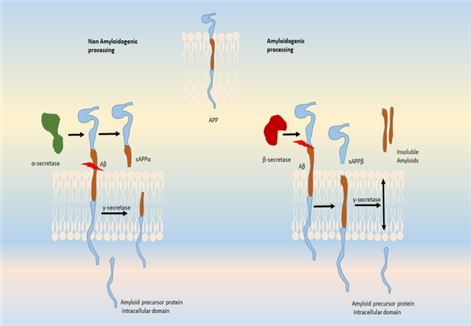
尽管目前还没有药物可以逆转阿尔兹海默病,但许多治疗药物被用来对抗这种疾病中出现的神经递质短缺和失衡。例如:乙酰胆碱酯酶抑制剂(AChEIs),如多奈哌齐、加兰他敏和利瓦斯汀,可增加突触上乙酰胆碱的可利用性。临床试验中的其他药物如γ-分泌酶抑制剂,BACE抑制剂,α-分泌酶调节剂,淀粉样蛋白聚集抑制剂等针对细胞外间隙和神经元中异常蛋白(淀粉样蛋白和tau蛋白)的积累,以防止它们的错误折叠。激酶抑制剂也是正在研究的治疗靶点,以防止tau蛋白的过度磷酸化或聚集。其他正在进行临床试验的治疗方法包括抗炎药物和补体阻滞剂,促进神经再生的生长因子,以及干细胞治疗。
目前商业可用的即用型试剂可以减少阿尔兹海默病研究时间,控制成本。上海金畔生物科技有限公司代理的Lifespan,Agrisera,MyBioSource是全球专业的抗体及ELISA试剂盒研发供应商。为广大客户提供高质量产品及专业的售前售后技术服务。小编汇总了有关阿尔兹海默病研究的部分相关产品:
|
品牌
|
货号
|
品名
|
|
Agrisera
|
AS20 4455
|
APP | Amyloid Precursor Protein (N-term)
|
|
Agrisera
|
AS06 154
|
PEN2 | gamma-secretase subunit PEN-2
|
|
Agrisera
|
AS10 932
|
Amyloid beta oligomer-specific monoclonal antibody (OMAB)
|
|
Agrisera
|
AS13 2691
|
BDNF | Brain-derived neurotrophic factor
|
|
Lifespan
|
LS-A1193
|
IHC‑plus™ Polyclonal Rabbit anti‑Human GPR68 / OGR1 Antibody (Extracellular Domain, IHC)
|
|
Lifespan
|
LS‑A443
|
PathPlusTM Polyclonal Rabbit anti‑Human GPR78 Antibody (Cytoplasmic Domain, IHC)
|
|
Lifespan
|
LS‑A7979
|
PathPlusTM Polyclonal Rabbit anti‑Human CDC7 Antibody (Kinase Domain, IHC)
|
|
Lifespan
|
LS‑A463
|
PathPlusTM Polyclonal Rabbit anti‑Human NPFF2 / NPFFR2 Antibody (N‑Terminus, IHC)
|
|
Lifespan
|
LS‑A1851
|
PathPlusTM Polyclonal Rabbit anti‑Human OR51E1 Antibody (Cytoplasmic Domain, IHC)
|
|
Lifespan
|
LS-F9437
|
Human TRPA1 (Sandwich ELISA) ELISA Kit
|
|
Lifespan
|
LS-F35287
|
Human CDK12 / CRKRS (Sandwich ELISA) ELISA Kit
|
|
Lifespan
|
LS-F22046
|
Human GPER1 / GPR30 (Sandwich ELISA) ELISA Kit
|
|
Lifespan
|
LS-F22050
|
Human PRKCZ / PKC-Zeta (Sandwich ELISA) ELISA Kit
|
|
MyBioSource
|
MBS9343770
|
Human Phosphorylated Tau (PT) ELISA Kit
|
|
MyBioSource
|
MBS2533168
|
Human Beta Amyloid (Abeta42) CLIA Kit
|
|
MyBioSource
|
MBS269761
|
Human Beta Amyloid Precursor Protein (betaAPP), ELISA Kit
|
|
MyBioSource
|
MBS7041908
|
Beta Amyloid Polyclonal Antibody Pair
|
|
MyBioSource
|
MBS960834
|
Recombinant Human Beta Amyloid protein
|
|
MyBioSource
|
MBS639489
|
Alzheimer’s Disease, Brain Tissue Microarray
|
|
MyBioSource
|
MBS654365
|
Alzheimer’s Disease, Brain Genomic DNA
|
上海金畔作为LifeSpan,Agrisera,MyBioSource品牌中国代理,为广大客户提供一站式售前售后服务。如对更多阿尔兹海默病相关产品感兴趣欢迎拨打上海金畔生物科技有限公司客服热线021-50837765或登录官方网站www.jinpanbio.cn了解更多信息。
[1] Tiwari S et al. Alzheimer’s disease: pathogenesis, diagnostics, and therapeutics. (2019) Int J Nanomedicine. 14:5541-5554. https://doi.org:10.2147/IJN.S200490
[2]Crews, L Masliah E. Molecular mechanisms of neurodegeneration in Alzheimer’s disease. (2010). Hum Mol Genet. 19(R1):R12-R20. https://doi:10.1093/hmg/ddq160
[3]Xu, Y et al. (2020). GPR68 deletion impairs hippocampal long-term potentiation and passive avoidance behavior. Molecular Brain. 13:132. https://doi.org/10.1186/s13041-020-00672-8
[4] Zhao, J et al. (2016). G Protein-Coupled Receptors (GPCRs) in Alzheimer’s Disease: A Focus on BACE1 Related GPCRs. Frontiers in Aging Neuroscience Vol8, Article 58:1-15. https://doi.org/10.3389/fnagi.2016.00058