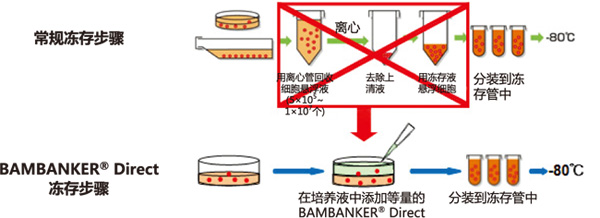
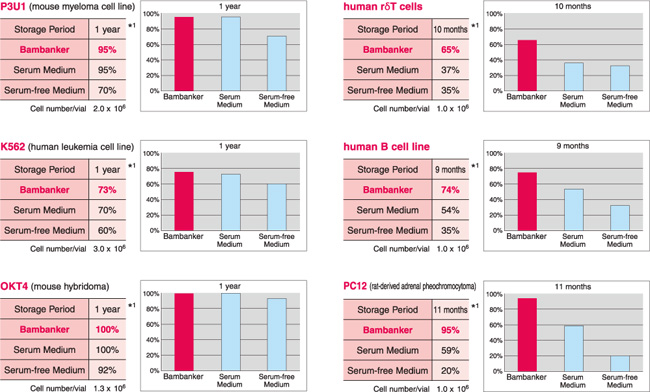
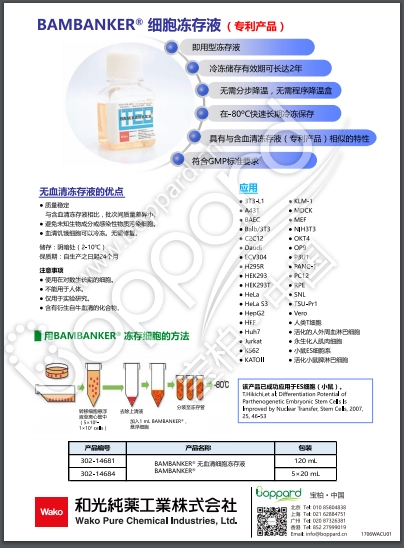
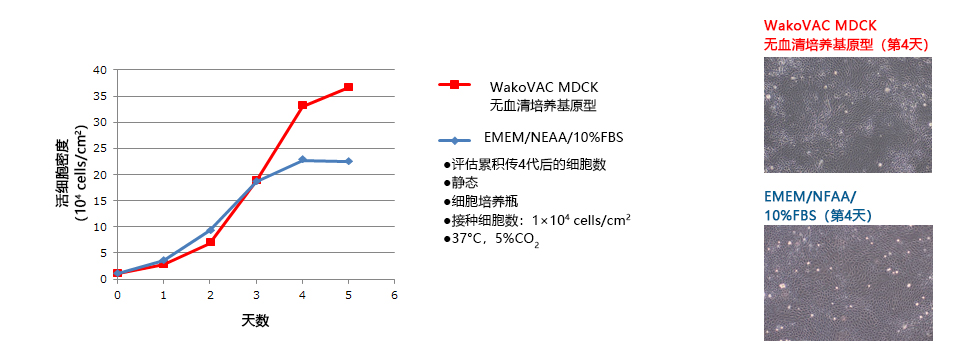
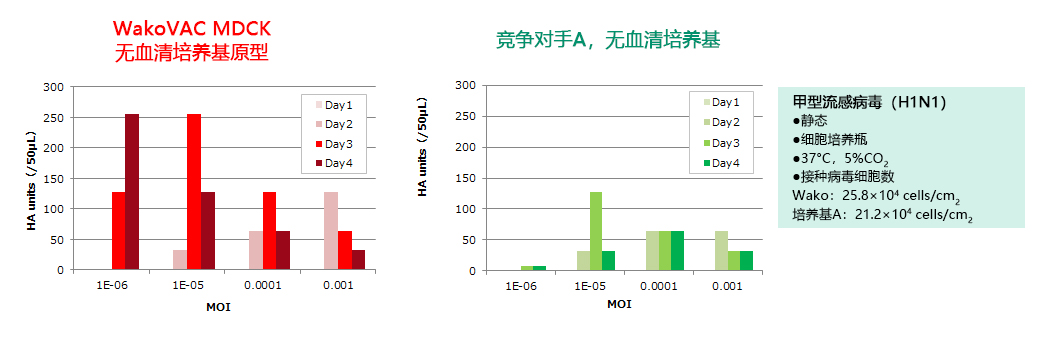
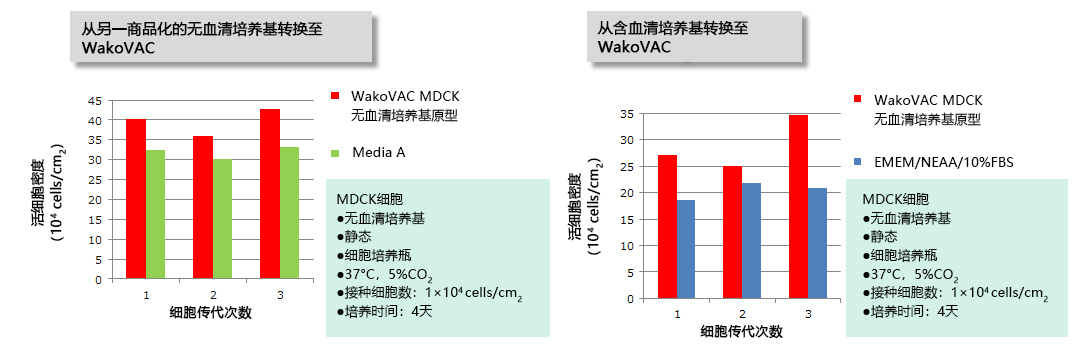
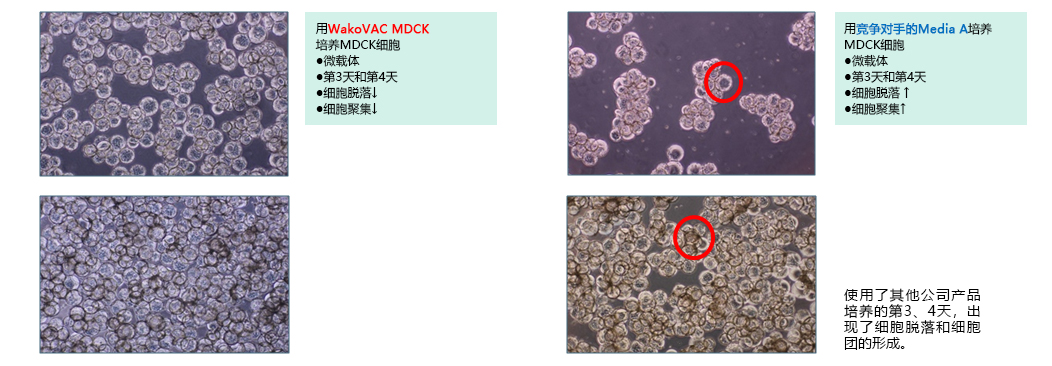
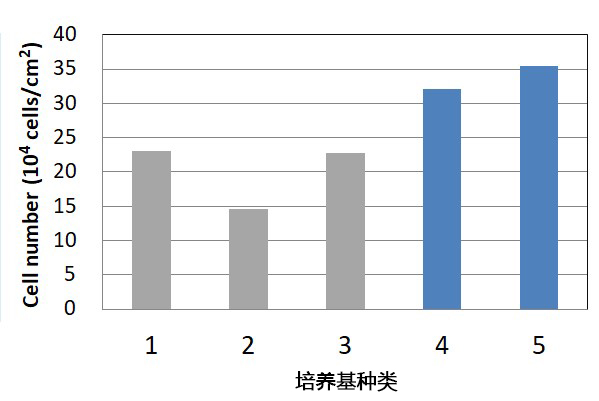
|
[1]
|
Zhang C., Seo J., Nakamura T. (2018) Cellular Approaches in Investigating Argonaute2-Dependent RNA Silencing. In: Okamura K., Nakanishi K. (eds) Argonaute Proteins. Methods in Molecular Biology, vol 1680. Humana Press, New York, NY.
|
|
[2]
|
Sharma, A., M¨ucke, M., & Seidman, C. E. (2018). Human induced pluripotent stem cell production and expansion from blood using a non-integrating viral reprogramming vector. Current Protocols in Molecular Biology,122, e58. doi: 10.1002/cpmb.58.
|
|
[3]
|
Souta Motoike, Mikihito Kajiya, Nao Komatsu, et al. Cryopreserved clumps of mesenchymal stem cell/extracellular matrix complexes retain osteogenic capacity and induce bone regeneration. Stem Cell Res Ther. 2018; 9: 73. Published online 2018 Mar 21. doi: 10.1186/s13287-018-0826-0.
|
|
[4]
|
Konuma T1, Kohara C1, Watanabe E2, et al. Monocyte subsets and their phenotypes during treatment with BCR-ABL1 tyrosine kinase inhibitors for Philadelphia chromosome-positive leukemia. Hematol Oncol. 2018 Apr;36(2):451-456. doi: 10.1002/hon.2497. Epub 2018 Feb 12.
|
|
[5]
|
Srijaya Thekkeparambil Chandrabose, Sandhya Sriram, et al. Amenable epigenetic traits of dental pulp stem cells underlie high capability of xeno-free episomal reprogramming.
Stem Cell Research & Therapy 2018 9:68.
|
|
[6]
|
Evans, Michael A. et al. "Macrophage-Mediated Delivery of Light Activated Nitric Oxide Prodrugs with Spatial, Temporal and Concentration Control." Chemical Science (2018): n. pag. Web. doi:10.1039/C8SC00015H.
|
|
[7]
|
Jauregui, C.; Yoganarasimha, S.; Madurantakam, P. Mesenchymal Stem Cells Derived from Healthy and Diseased Human Gingiva Support Osteogenesis on Electrospun Polycaprolactone Scaffolds. Bioengineering 2018, 5, 8.
|
|
[8]
|
Khamaikawin, Wannisa et al. Modeling Anti-HIV-1 HSPC-Based Gene Therapy in Humanized Mice Previously Infected with HIV-1. Molecular Therapy – Methods & Clinical Development , Volume 9,23-32.
|
|
[9]
|
Masako Okumura, Toyoaki Natsume, Masato T Kanemaki, Tomomi Kiyomitsu. Optogenetic reconstitution reveals that Dynein-Dynactin-NuMA clusters generate cortical spindle-pulling forces as a multi-arm ensemble. bioRxiv 277202; doi: https://doi.org/10.1101/277202
|
|
[10]
|
https://labchem.wako-chem.co.jp/journal/docs/proup10.pdf<链接>
|
|
[11]
|
Ince T A, Aster J C. In vitro culture conditions for T-cell acute lymphoblastic leukemia/lymphoma: U.S. Patent 9,683,217[P]. 2017-6-20.
|
|
[12]
|
Morris C D, Azadnia P, de Val N, et al. Differential Antibody Responses to Conserved HIV-1 Neutralizing Epitopes in the Context of Multivalent Scaffolds and Native-Like gp140 Trimers[J]. mBio, 2017, 8(1): e00036-17.<链接>
|
|
[13]
|
Lee K, Saetern O C, Nguyen A, et al. Derivation of Leptomeninges Explant Cultures from Postmortem Human Brain Donors[J]. JoVE (Journal of Visualized Experiments), 2017 (119): e55045-e55045.<链接>
|
|
[14]
|
Buenrostro J D, Corces R, Wu B, et al. Single-cell epigenomics maps the continuous regulatory landscape of human hematopoietic differentiation[J]. bioRxiv, 2017: 109843.<链接>
|
|
[15]
|
Edmonds R E, Garvican E R, Smith R K W, et al. Influence of commonly used pharmaceutical agents on equine bone marrow‐derived mesenchymal stem cell viability[J]. Equine veterinary journal, 2017, 49(3): 352-357.<链接>
|
|
[16]
|
Jitraruch S, Dhawan A, Hughes R D, et al. Cryopreservation of Hepatocyte Microbeads for Clinical Transplantation[J]. Cell transplantation, 2017.<链接>
|
|
[17]
|
Usarek E, Barańczyk-Kuźma A, Kaźmierczak B, et al. Validation of qPCR reference genes in lymphocytes from patients with amyotrophic lateral sclerosis[J]. PloS one, 2017, 12(3): e0174317.<链接>
|
|
[18]
|
Gagnon E, Connolly A, Dobbins J, et al. Studying Dynamic Plasma Membrane Binding of TCR-CD3 Chains During Immunological Synapse Formation Using Donor-Quenching FRET and FLIM-FRET[J]. The Immune Synapse: Methods and Protocols, 2017: 259-289.<链接>
|
|
[19]
|
Foster K, Chaddock J, Penn C, et al. Non-cytotoxic protein conjugates: U.S. Patent 9,474,807[P]. 2016-10-25.
|
|
[20]
|
Araki N, Iida M, Machida K. Bioassay method for detecting physiologically active substance: U.S. Patent 9,316,588[P]. 2016-4-19.
|
|
[21]
|
Sazinsky S, Michaelson J S, Sathyanarayanan S, et al. Antibodies to icos: U.S. Patent Application 15/076,867[P]. 2016-3-22
|
|
[22]
|
李凯. Studies on Innate Immune Activation by HBV Infection and Its Sensing Mechanism in Hepatocytes[J]. 2016.
|
|
[23]
|
Ip L R H. Effect of INPP4B loss on DNA repair and treatment strategies in ovarian cancer[D]. UCL (University College London), 2016.
|
|
[24]
|
Thakkar A. Novel hormonal combination therapy for triple negative breast cancer[D]. University of Miami, 2016.
|
|
[25]
|
Pakdaman Y. In-vitro characterization of STUB1 mutations in recessively inherited spinocerebellar ataxia-16[D]. The University of Bergen, 2016.
|
|
[26]
|
Caxaria S. Induced pluripotent stem cells (iPSCs) for research and therapy: induction of hepatic differentiation in iPSCs and evaluation of their quality as a model of in vivo development in the context of coagulation[D]. UCL (University College London), 2016.<链接>
|
|
[27]
|
Bayne R A, Donnachie D J, Kinnell H L, et al. BMP signalling in human fetal ovary somatic cells is modulated in a gene-specific fashion by GREM1 and GREM2[J]. MHR: Basic science of reproductive medicine, 2016, 22(9): 622-633.<链接>
|
|
[28]
|
Friedrich D. HIF-1 [alpha] Drives Fungal Immunity in Human Macrophages[D]. Universität zu Lübeck, 2016.<链接>
|
|
[29]
|
Yasuda M, Kawabata J, Akieda-Asai S, et al. Guanylyl cyclase C and guanylin reduce fat droplet accumulation in cattle mesenteric adipose tissue[J]. The Journal of Veterinary Science, 2016.<链接>
|
|
[30]
|
Campa M J, Moody M A, Zhang R, et al. Interrogation of individual intratumoral B lymphocytes from lung cancer patients for molecular target discovery[J]. Cancer Immunology, Immunotherapy, 2016, 65(2): 171-180.<链接>
|
|
[31]
|
Kobayashi T, Yagi Y, Nakamura T. Development of Genome Engineering Tools from Plant-Specific PPR Proteins Using Animal Cultured Cells[J]. Chromosome and Genomic Engineering in Plants: Methods and Protocols, 2016: 147-155.<链接>
|
|
[32]
|
Shikata H, Kaku M, Kojima S I, et al. The effect of magnetic field during freezing and thawing of rat bone marrow-derived mesenchymal stem cells[J]. Cryobiology, 2016, 73(1): 15-19.<链接>
|
|
[33]
|
Hirakawa M, Matos T, Liu H, et al. Low-dose IL-2 selectively activates subsets of CD4+ Tregs and NK cells[J]. JCI insight, 2016, 1(18).<链接>
|
|
[34]
|
Durruthy-Durruthy J, Sebastiano V, Wossidlo M, et al. The primate-specific noncoding RNA HPAT5 regulates pluripotency during human preimplantation development and nuclear reprogramming[J]. Nature genetics, 2016, 48(1): 44-52.<链接>
|
|
[35]
|
Caxaria S, Arthold S, Nathwani A C, et al. Generation of integration-free patient specific iPS cells using episomal plasmids under feeder free conditions[J]. Patient-Specific Induced Pluripotent Stem Cell Models: Generation and Characterization, 2016: 355-366.<链接>
|
|
[36]
|
Nonomura Y, Otsuka A, Nakashima C, et al. Peripheral blood Th9 cells are a possible pharmacodynamic biomarker of nivolumab treatment efficacy in metastatic melanoma patients[J]. Oncoimmunology, 2016, 5(12): e1248327.<链接>
|
|
[37]
|
Burridge P W, Diecke S, Matsa E, et al. Modeling cardiovascular diseases with patient-specific human pluripotent stem cell-derived cardiomyocytes[J]. Patient-Specific Induced Pluripotent Stem Cell Models: Generation and Characterization, 2016: 119-130.<链接>
|
|
[38]
|
Mendonça M C P, Soares E S, de Jesus M B, et al. PEGylation of Reduced Graphene Oxide Induces Toxicity in Cells of the Blood–Brain Barrier: An in Vitro and in Vivo Study[J]. Molecular pharmaceutics, 2016, 13(11): 3913-3924.<链接>
|
|
[39]
|
Eldaim A, Hashimoto O, Ohtsuki H, et al. Expression of uncoupling protein 1 in bovine muscle cells[J]. Journal of animal science, 2016, 94(12): 5097-5104.<链接>
|
|
[40]
|
Zhen A, Rezek V, Youn C, et al. Stem-cell based engineered immunity against HIV infection in the humanized mouse model[J]. JoVE (Journal of Visualized Experiments), 2016 (113): e54048-e54048.<链接>
|
|
[41]
|
Bastian N A, Bayne R A, Hummitzsch K, et al. Regulation of fibrillins and modulators of TGFβ in fetal bovine and human ovaries[J]. Reproduction, 2016, 152(2): 127-137.<链接>
|
|
[42]
|
Eto K, Takayama N, Nakamura S, et al. Method for producing differentiated cells: U.S. Patent 9,200,254[P]. 2015-12-1.
|
|
[43]
|
Eto K, Takayama N, Nakamura S, et al. Novel Method for Producing Differentiated Cells: U.S. Patent Application 14/925,508[P]. 2015-10-28.
|
|
[44]
|
Yamashita J, Takeda M. Cd82-positive cardiac progenitor cells: U.S. Patent Application 15/308,147[P]. 2015-4-16.
|
|
[45]
|
Cai Y, Sugimoto C, Arainga M, et al. Preferential Destruction of Interstitial Macrophages over Alveolar Macrophages as a Cause of Pulmonary Disease in Simian Immunodeficiency Virus–Infected Rhesus Macaques[J]. The Journal of Immunology, 2015, 195(10): 4884-4891.<链接>
|
|
[46]
|
Kojima S I, Kaku M, Kawata T, et al. Cranial suture-like gap and bone regeneration after transplantation of cryopreserved MSCs by use of a programmed freezer with magnetic field in rats[J]. Cryobiology, 2015, 70(3): 262-268.<链接>
|
|
[47]
|
Egawa E Y, Kitamura N, Nakai R, et al. A DNA hybridization system for labeling of neural stem cells with SPIO nanoparticles for MRI monitoring post-transplantation[J]. Biomaterials, 2015, 54: 158-167.<链接>
|
|
[48]
|
Durruthy J D, Sebastiano V. Derivation of GMP-Compliant Integration-Free hiPSCs Using Modified mRNAs[J]. Stem Cells and Good Manufacturing Practices: Methods, Protocols, and Regulations, 2015: 31-42.<链接>
|
|
[49]
|
Sato Y, Sasaki T, Takahashi S, et al. Development of a highly reproducible system to evaluate inhibition of cytochrome P450 3A4 activity by natural medicines[J]. Journal of Pharmacy & Pharmaceutical Sciences, 2015, 18(4): 316-327.<链接>
|
|
[50]
|
Burridge P W, Holmström A, Wu J C. Chemically defined culture and cardiomyocyte differentiation of human pluripotent stem cells[J]. Current protocols in human genetics, 2015: 21.3. 1-21.3. 15.<链接>
|
|
[51]
|
Käding N. Hypoxia Regulates Host Cell Metabolism and Thereby Enhancing Clamydia Pneumonia Growth[D]. Zentrale Hochschulbibliothek Lübeck, 2015.<链接>
|
|
[52]
|
Lu S. Calcium Dependent Regulatory Mechanism in Wolfram Syndrome: A Dissertation[J]. 2015.
|
|
[53]
|
Garvican E R, Cree S, Bull L, et al. Viability of equine mesenchymal stem cells during transport and implantation[J]. Stem cell research & therapy, 2014, 5(4): 1.<链接>
|
|
[54]
|
Deng X, Terunuma H, Nieda M. Method for producing nk cell-enriched blood preparation: U.S. Patent Application 14/508,745[P]. 2014-10-7.
|
|
[55]
|
Foster K, Chaddock J, Penn C, et al. Non-cytotoxic protein conjugates: U.S. Patent 8,778,634[P]. 2014-7-15.
|
|
[56]
|
Ramathal C Y, Dumuthy-Durruthy J, Pera R A R, et al. Generation of male germ cells: U.S. Patent Application 14/904,396[P]. 2014-7-10
|
|
[57]
|
Ince T A. Assays, methods and kits for analyzing sensitivity and resistance to anti-cancer drugs, predicting a cancer patient's prognosis, and personalized treatment strategies: U.S. Patent Application 14/894,595[P]. 2014-6-4.
|
|
[58]
|
Nishio M, Saeki K. Differentiation of human pluripotent stem cells into highly functional classical brown adipocytes[J]. Methods Enzymol, 2014, 537: 177-197.<链接>
|
|
[59]
|
Durruthy-Durruthy J, Briggs S F, Awe J, et al. Rapid and efficient conversion of integration-free human induced pluripotent stem cells to GMP-grade culture conditions[J]. PloS one, 2014, 9(4): e94231.<链接>
|
|
[60]
|
Koido S, Homma S, Okamoto M, et al. Treatment with Chemotherapy and Dendritic Cells Pulsed with Multiple Wilms' Tumor 1 (WT1)–Specific MHC Class I/II–Restricted Epitopes for Pancreatic Cancer[J]. Clinical Cancer Research, 2014, 20(16): 4228-4239.<链接>
|
|
[61]
|
Patz Jr E F. Antibodies Expressed by Intratumoral B Cells as the Basis for a Diagnostic Test for Lung Cancer[R]. DUKE UNIV DURHAM NC, 2014.<链接>
|
|
[62]
|
Kaku M, Shimasue H, Ohtani J, et al. A case of tooth autotransplantation after long-term cryopreservation using a programmed freezer with a magnetic field[J]. The Angle Orthodontist, 2014, 85(3): 518-524.<链接>
|
|
[63]
|
Kaku M, Koseki H, Kojima S, et al. Cranial bone regeneration after cranioplasty using cryopreserved autogenous bone by a programmed freezer with a magnetic field in rats[J]. CryoLetters, 2014, 35(6): 451-461.<链接>
|
|
[64]
|
Koido S, Kinoshita S, Mogami T, et al. Immunological assessment of cryotherapy in breast cancer patients[J]. Anticancer research, 2014, 34(9): 4869-4876.<链接>
|
|
[65]
|
Sazuka S, Katsuno T, Nakagawa T, et al. Fibrocytes are involved in inflammation as well as fibrosis in the pathogenesis of Crohn's disease[J]. Digestive diseases and sciences, 2014, 59(4): 760-768.<链接>
|
|
[66]
|
Lin S L, Lee S Y, Lin Y C, et al. Evaluation of mechanical and histological properties of cryopreserved human premolars under short-term preservation: A preliminary study[J]. Journal of Dental Sciences, 2014, 9(3): 244-248.<链接>
|
|
[67]
|
Poole E, Reeves M, Sinclair J H. The use of primary human cells (fibroblasts, monocytes, and others) to assess human cytomegalovirus function[J]. Human Cytomegaloviruses: Methods and Protocols, 2014: 81-98.<链接>
|
|
[68]
|
Garvican E R, Dudhia J, Alves A L, et al. Mesenchymal stem cells modulate release of matrix proteins from tendon surfaces in vitro: a potential beneficial therapeutic effect[J]. Regenerative medicine, 2014, 9(3): 295-308.<链接>
|
|
[69]
|
Skinner J A, Zurawski S M, Sugimoto C, et al. Immunologic characterization of a rhesus macaque H1N1 challenge model for candidate influenza vaccine assessment[J]. Clinical and Vaccine Immunology, 2014: CVI. 00547-14.<链接>
|
|
[70]
|
Terunuma H, Deng X, Nieda M. Method for producing nk cell-enriched blood preparation: U.S. Patent Application 14/780,394[P]. 2013-3-27.
|
|
[71]
|
Cho M, Yamazaki T, Endo M, et al. Anti-Phospholipase D4 Antibody: U.S. Patent Application 14/375,266[P]. 2013-1-31.
|
|
[72]
|
Bhandari S. Radiological, clinical and laboratory based studies in the pathogenesis of desmoid tumours in familial adenomatous polyposis[J]. 2013.
|
|
[73]
|
Gonzàlez Juncà A. Study of molecular mechanisms implicated in the TGF-beta oncogenic effect in Glioma[J]. 2013.
|
|
[74]
|
Koseki H, Kaku M, Kawata T, et al. Cryopreservation of osteoblasts by use of a programmed freezer with a magnetic field[J]. CryoLetters, 2013, 34(1): 10-19.<链接>
|
|
[75]
|
Naito H, Yoshimura M, Mizuno T, et al. The advantages of three‐dimensional culture in a collagen hydrogel for stem cell differentiation[J]. Journal of Biomedical Materials Research Part A, 2013, 101(10): 2838-2845.<链接>
|
|
[76]
|
Stec M, Baran J, Szatanek R, et al. Properties of monocytes generated from haematopoietic CD34+ stem cells from bone marrow of colon cancer patients[J]. Cancer Immunology, Immunotherapy, 2013, 62(4): 705-713.<链接>
|
|
[77]
|
Müller L, Brighton L E, Carson J L, et al. Culturing of human nasal epithelial cells at the air liquid interface[J]. Journal of visualized experiments: JoVE, 2013 (80).<链接>
|
|
[78]
|
Kalaszczynska I, Ruminski S, Platek A E, et al. Substantial differences between human and ovine mesenchymal stem cells in response to osteogenic media: how to explain and how to manage?[J]. BioResearch open access, 2013, 2(5): 356-363.<链接>
|
|
[79]
|
Tamai Y, Hasegawa A, Takamori A, et al. Potential Contribution of a Novel Tax Epitope–Specific CD4+ T Cells to Graft-versus-Tax Effect in Adult T Cell Leukemia Patients after Allogeneic Hematopoietic Stem Cell Transplantation[J]. The Journal of Immunology, 2013, 190(8): 4382-4392.<链接>
|
|
[80]
|
Kasai K, Nakashima H, Liu F, et al. Toxicology and biodistribution studies for MGH2. 1, an oncolytic virus that expresses two prodrug-activating genes, in combination with prodrugs[J]. Molecular Therapy-Nucleic Acids, 2013, 2: e113.<链接>
|
|
[81]
|
Deng X, Terunuma H, Nieda M. Method for producing nk cell-enriched blood preparation: U.S. Patent Application 13/980,777[P]. 2012-1-17.
|
|
[82]
|
Somm E, Bonnet N, Martinez A, et al. A botulinum toxin–derived targeted secretion inhibitor downregulates the GH/IGF1 axis[J]. The Journal of clinical investigation, 2012, 122(9): 3295.<链接>
|
|
[83]
|
Takaoka E, Sonobe H, Akimaru K, et al. Multiple sites of highly amplified DNA sequences detected by molecular cytogenetic analysis in HS-RMS-2, a new pleomorphic rhabdomyosarcoma cell line[J]. American journal of cancer research, 2012, 2(2): 141.<链接>
|
|
[84]
|
Fahlbusch F B, Dawood Y, Hartner A, et al. Cullin 7 and Fbxw 8 expression in trophoblastic cells is regulated via oxygen tension: implications for intrauterine growth restriction?[J]. The Journal of Maternal-Fetal & Neonatal Medicine, 2012, 25(11): 2209-2215.<链接>
|
|
[85]
|
Aloé S, Weber F, Behr B, et al. Modulatory effects of bovine seminal plasma on uterine inflammatory processes[J]. Reproduction in domestic animals, 2012, 47(1): 12-19.<链接>
|
|
[86]
|
Gupta A, Bhakta S. An integrated surrogate model for screening of drugs against Mycobacterium tuberculosis[J]. Journal of antimicrobial chemotherapy, 2012, 67(6): 1380-1391.<链接>
|
|
[87]
|
Saeki K. Feeder-Free Culture for High Efficiency Production of Subculturable Vascular Endothelial Cells from Human Embryonic Stem Cells[J]. Human Embryonic and Induced Pluripotent Stem Cells: Lineage-Specific Differentiation Protocols, 2012: 277-294.<链接>
|
|
[88]
|
Yamazaki T, Okabe H, Kobayashi S, et al. Cancer stem cell mass and process for production thereof: U.S. Patent Application 13/878,181[P]. 2011-10-6.
|
|
[89]
|
Deng X, Terunuma H, Nieda M. Method for producing nk cell-enriched blood product: U.S. Patent Application 13/577,476[P]. 2011-2-4.
|
|
[90]
|
Sugii S, Kida Y, Berggren W T, et al. Feeder-independent ips cell derivation from human and mouse adipose stem cells[J]. Nature protocols, 2011, 6(3): 346.<链接>
|
|
[91]
|
Shinada T, Akimoto T, Zhu Y, et al. Modulation of viability of live cells by focused ion‐beam exposure[J]. Biotechnology and bioengineering, 2011, 108(1): 222-225.<链接>
|
|
[92]
|
Huang M S, Chang W J, Huang H M, et al. Effects of transportation time after extraction on the magnetic cryopreservation of pulp cells of rat dental pulp[J]. Journal of Dental Sciences, 2011, 6(1): 48-52.<链接>
|
|
[93]
|
Sato D, Suzuki Y, Kano T, et al. Tonsillar TLR9 expression and efficacy of tonsillectomy with steroid pulse therapy in IgA nephropathy patients[J]. Nephrology Dialysis Transplantation, 2011, 27(3): 1090-1097.<链接>
|
|
[94]
|
Kamada H, Kaku M, Kawata T, et al. In-vitro and in-vivo study of periodontal ligament cryopreserved with a magnetic field[J]. American Journal of Orthodontics and Dentofacial Orthopedics, 2011, 140(6): 799-805.<链接>
|
|
[95]
|
Bui H T, Wakayama S, Mizutani E, et al. Essential role of paternal chromatin in the regulation of transcriptional activity during mouse preimplantation development[J]. Reproduction, 2011, 141(1): 67-77.<链接>
|
|
[96]
|
Takata Y, Kishine H, Sone T, et al. Generation of iPS cells using a BacMam multigene expression system[J]. Cell structure and function, 2011, 36(2): 209-222.<链接>
|
|
[97]
|
Benko Z, Zhao R Y. Zeocin for selection of bleMX6 resistance in fission yeast[J]. Biotechniques, 2011, 51(1): 57-60.<链接>
|
|
[98]
|
Abedini S, Kaku M, Kawata T, et al. Effects of cryopreservation with a newly-developed magnetic field programmed freezer on periodontal ligament cells and pulp tissues[J]. Cryobiology, 2011, 62(3): 181-187.<链接>
|
|
[99]
|
Oshima-Sudo N, Li Q, Hoshino Y, et al. Optimized method for culturing outgrowth endothelial progenitor cells[J]. Inflammation and Regeneration, 2011, 31(2): 219-227.<链接>
|
|
[100]
|
Araki N. Bioassay method for antibody against thyroid-stimulating hormone receptor, measurement kit for the antibody, and novel genetically modified cell for use in the bioassay method or the measurement kit: U.S. Patent Application 13/381,402[P]. 2010-6-24.
|
|
[101]
|
Foster K, Chaddock J, Marks P, et al. Fusion proteins: U.S. Patent 7,659,092[P]. 2010-2-9.
|
|
[102]
|
Mieno S, Boodhwani M, Robich M P, et al. Effects of diabetes mellitus on VEGF‐induced proliferation response in bone marrow derived endothelial progenitor cells[J]. Journal of cardiac surgery, 2010, 25(5): 618-625.<链接>
|
|
[103]
|
Kaku M, Kamada H, Kawata T, et al. Cryopreservation of periodontal ligament cells with magnetic field for tooth banking[J]. Cryobiology, 2010, 61(1): 73-78.<链接>
|
|
[104]
|
Kawata T, Kaku M, Fujita T, et al. Water molecule movement by a magnetic field in freezing for tooth banking[J]. Biomedical Research, 2010, 21(4).<链接>
|
|
[105]
|
Lee S Y, Chiang P C, Tsai Y H, et al. Effects of cryopreservation of intact teeth on the isolated dental pulp stem cells[J]. Journal of Endodontics, 2010, 36(8): 1336-1340.<链接>
|
|
[106]
|
Huang Y H, Yang J C, Wang C W, et al. Dental stem cells and tooth banking for regenerative medicine[J]. Journal of Experimental & Clinical Medicine, 2010, 2(3): 111-117.<链接>
|
|
[107]
|
Kwon H J, Enomoto T, Shimogawara M, et al. Benchmarks[J]. Biotechniques, 2010, 48: 460-462.<链接>
|
|
[108]
|
Shimizu Y, Takamori A, Utsunomiya A, et al. Impaired Tax‐specific T‐cell responses with insufficient control of HTLV‐1 in a subgroup of individuals at asymptomatic and smoldering stages[J]. Cancer science, 2009, 100(3): 481-489.<链接>
|
|
[109]
|
Park H S, Cho S G, Park M J, et al. Bone marrow T cells are superior to splenic T cells to induce chimeric conversion after non-myeloablative bone marrow transplantation[J]. The Korean journal of internal medicine, 2009, 24(3): 252.<链接>
|
|
[110]
|
Enosawa S, Miyamoto Y, Ikeya T. Frozen cell immobilized product, primary hepatocyte culture tool, and method for producing primary hepatocyte culture tool: U.S. Patent Application 12/738,809[P]. 2008-9-11.
|
|
[111]
|
DePinho R A, Stommel J M. Receptor tyrosine kinase profiling: U.S. Patent Application 12/450,820[P]. 2008-4-11.
|
|
[112]
|
Mieno S, Clements R T, Boodhwani M, et al. Characteristics and Function of Cryopreserved Bone Marrow–Derived Endothelial Progenitor Cells[J]. The Annals of thoracic surgery, 2008, 85(4): 1361-1366.<链接>
|
|
[113]
|
Warren C. The Response of HN4 Cells to Porphyromonas gingivalis DNA[D]. , 2008.
|
|
[114]
|
Hikichi T, Wakayama S, Mizutani E, et al. Differentiation potential of parthenogenetic embryonic stem cells is improved by nuclear transfer[J]. Stem Cells, 2007, 25(1): 46-53.<链接>
|
|
[115]
|
Zaidi S K, Pande S, Pratap J, et al. Runx2 deficiency and defective subnuclear targeting bypass senescence to promote immortalization and tumorigenic potential[J]. Proceedings of the National Academy of Sciences, 2007, 104(50): 19861-19866.<链接>
|
|
[116]
|
Hikichi T, Wakayama S, Mizutani E, et al. Differentiation potential of parthenogenetic embryonic stem cells is improved by nuclear transfer[J]. Stem Cells, 2007, 25(1): 46-53.<链接>
|
|
[117]
|
Liu D G, Kobayashi T, Onishi A, et al. Relation between human decay‐accelerating factor (hDAF) expression in pig cells and inhibition of human serum anti‐pig cytotoxicity: value of highly expressed hDAF for xenotransplantation[J]. Xenotransplantation, 2007, 14(1): 67-73.<链接>
|
|
[118]
|
Ishii H, Iinuma A, Osumi K, et al. Canine tumor treatment method, pharmaceutical formulation applied thereto, and method of cryogenically preserving cells used therewith: U.S. Patent Application 11/465,892[P]. 2006-8-21.
|
|
[119]
|
Hatoya S, Sugiyama Y, Torii R, et al. Effect of co-culturing with embryonic fibroblasts on IVM, IVF and IVC of canine oocytes[J]. Theriogenology, 2006, 66(5): 1083-1090.<链接>
|
|
[120]
|
Sasaki M, Kato Y, Yamada H, et al. Development of a novel serum‐free freezing medium for mammalian cells using the silk protein sericin[J]. Biotechnology and applied biochemistry, 2005, 42(2): 183-188.<链接>
|
|
[121]
|
Haynes J E. Pseudonyms of Authors: Including Anonyms and Initialisms[M]. JE Haynes, 1882.<链接>
|

 增加3种产品!
增加3种产品!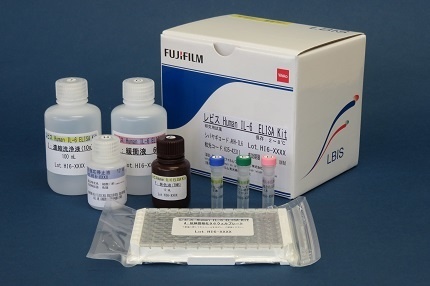
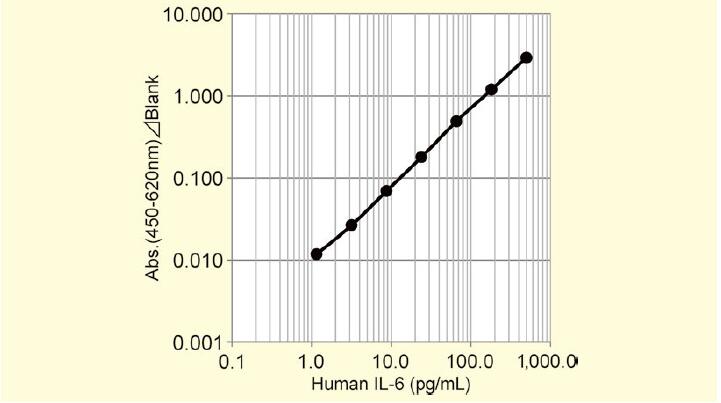




 N2 Supplement
N2 Supplement