可荧光定量活细胞的脂肪酸β-氧化(FAO)活性的试剂
FAOBlue
FAOBlue是一款可以通过蓝色荧光可视化脂肪酸分解的共同途径——脂肪酸β-氧化(FAO)的活性的试剂。
通过荧光成像,可以简单地检测出过去难以检测的活细胞中的脂肪酸β-氧化活性。
该产品可广泛应用于对比评估不同细胞种类之间的β-氧化,探索促进或抑制β-氧化活性的化合物,β-氧化相关酶群的基础研究等领域。
※ 本产品基于九州大学研究生院药学研究院药物发现化学生物学领域 王子田彰夫教授的研究成果,
※ 由Funakoshi株式会社商品化并销售。
※ 本产品仅供研究使用。
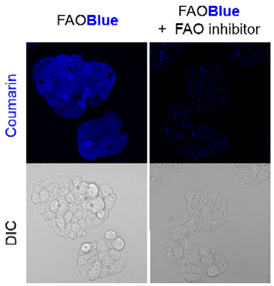
使用FAOBlue可视化HepG2细胞的FAO活性
添加FAOBlue到HepG2细胞中,观察活细胞成像,可从细胞中观察到蓝色荧光。另一方面,若使用FAO抑制剂进行前处理,则荧光强度明显减少,由此可知,蓝色荧光的强度取决于FAO的活性。
◆何为脂肪酸β-氧化(Fatty acid beta-oxidation; FAO)
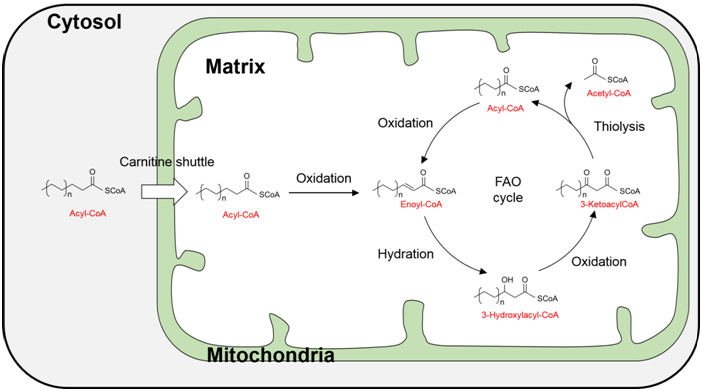
脂肪酸是构成细胞的各种脂质的基本要素,与葡萄糖、氨基酸并称为能源。尤其是在葡萄糖不足而饥饿的时候,脂肪酸会分解活跃,产生大量的ATP。虽然脂肪酸根据碳链的长短以及不饱和度的差别而存在不同的种类,但是由于它的分解属于线粒体等细胞器的共同分解途径,因此这种途径被统称为脂肪酸β-氧化(Fatty acid beta-oxidation; FAO)。
脂肪酸β-氧化主要通过4步酶反应——1)脂肪酸β位的氧化,2)β位的水合,3)β位的氧化,4)裂解,被阶段性分解为2个碳原子的短链脂肪酸和作为ATP原料的乙酰CoA。其中生成的2个碳原子的短链脂肪酸再通过同一个循环,以2n个碳原子的短链脂肪酸重复分解。
研究提出,癌症以及非酒精性肝炎(NASH)等疾病中,脂肪酸β-氧化会出现很大的变动,因此开发检测脂肪酸β-氧化活性的方法备受期待。然而,在活细胞中检测多种酶参与的脂肪酸β-氧化一直以来都十分困难。
FAOBlue是一款新型脂肪酸β-氧化应答型荧光探针,由九州大学研究生院药学研究院、专攻药物发现化学生物学领域的王子田彰夫教授开发。只需将产品添加到培养基中的简单操作,便可以通过荧光观察定量脂肪酸β-氧化活性。
◆原理
FAOBlue是一种在碳原子数为9的壬酸的碳链末端添加了蓝色荧光色素香豆素衍生物的化合物,此外,通过用乙酰氧基甲基酯保护末端脂肪酸来提高细胞膜透过性。虽然FAOBlue中含有香豆素衍生物,但是在该状态下,它不会在405 nm激发下发出荧光。
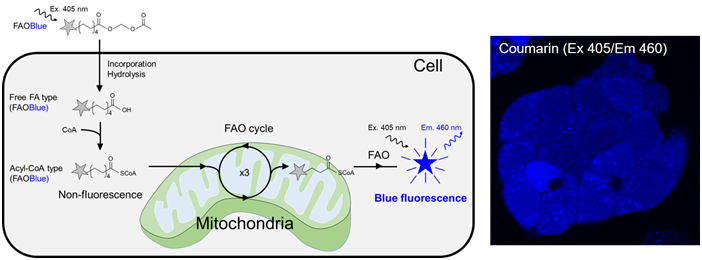
1. 附着在羧基的乙酰氧甲基具有高疏水性,因此FAOBlue可以跨越细胞膜,有效地摄入到细胞中。
2. 通过细胞内的酯水解酶去除乙酰氧基甲酯,转换成游离脂肪酸的形态。
3. 通过脂酰CoA合成酶转换成脂酰CoA,摄入β-氧化途径。
4. 通过β-氧化循环壬酸(C9)按庚酸(C7)、戊酸(C5)、丙酸(C3)的顺序转换,在第四次β-氧化循环的丙酸
4. 被分解时,香豆素衍生物被释放出来。香豆素衍生物在405 nm激发下发出蓝色荧光。
5. 由于游离的香豆素衍生物扩散到整个细胞中,因此通过检测细胞内的蓝色荧光强度,可以实时且定量的评价β-氧
4. 化活性。
※ 通过添加肉碱穿梭抑制剂的Etomoxir,有效地抑制了细胞内的荧光上升。
※ 该结果证明FAOBlue主要检测线粒体的FAO活性。
◆特点
● FAOBlue处于消光状态,分解后的游离香豆素衍生物呈现出比分解前更高的荧光强度。
● 添加培养基后,30 min~120 min后便可观察。
● 无需特别操作即可检测β-氧化活性。
● 实例验证能观察多种细胞类型的β-氧化。
● 有抑制药物依赖性β-氧化和因促进而引起的活性变化的成功检测案例。
● 检测波长:激发405 nm/荧光460 nm。
※ 注意:
使用共聚焦激光显微镜时,推荐使用405 nm激光激发。如果本试剂在330~380 nm的范围内激发的话,会观察到无关FAO活性的370~450 nm(最大荧光波长410 nm)的荧光。使用荧光显微镜时,为了特异性观察FAO活性,推荐选择激发波长在390~430 nm范围内的激发光滤光片。详情请参考数据实例:FAO特异性吸收光谱、荧光光谱的变化。
◆原著论文
Uchinomiya et. al., Chem. Commun. 56, 3023~3026 (2020) .
”Fluorescence Detection of Metabolic Activity of Fatty Acid Beta Oxidation Pathway in Living Cells.”
◆应用
● 评价各种细胞的β-氧化活性
● β-氧化相关的基因基础研究
● 抑制或促进β-氧化的化合物的探索 等
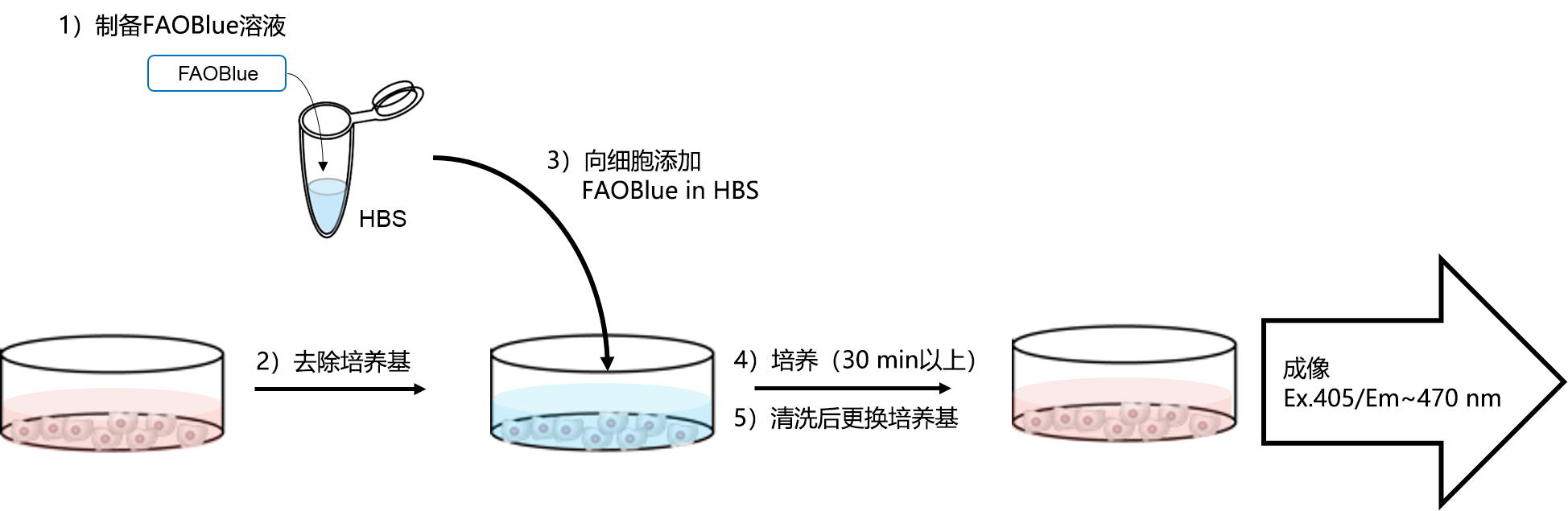
◆操作方法概况
1. 在HBS中溶解FAOBlue至终浓度为5~20 μM*1。
1. *1 针对不同的细胞类型,合适的浓度有所差异。建议根据具体实验进行探讨。
2. 去除培养基,用HBS清洗细胞2次。
3. 向细胞添加含有FAOBlue的HBS。
4. 在37°C下培养30 min以上*2。
1. *2 针对不同的细胞类型,合适的培养时长有所差异。建议根据具体实验进行探讨。
5. 更换培养基后*3,通过成像观察蓝色荧光(Ex. 405 nm/Em. 430~480 nm)。
1. *3 染色后的培养基更换是非必须的。即使不清洗也可进行观察。
实验注意点
由于本试剂使用405 nm的激发光,根据不同的观察对象,可能会观察到其自发的荧光。建议同时进行未添加本试剂的阴性对照实验。尤其是在显微镜下观察到点状荧光信号时,可能就是细胞的自发荧光。
◆应用实例
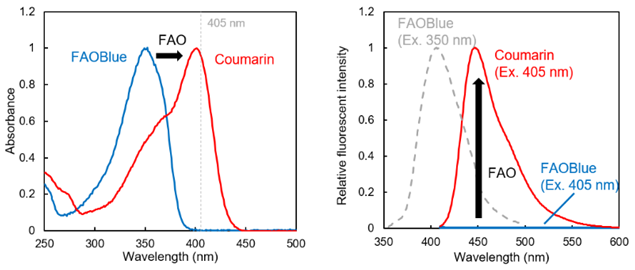
FAO特异性吸收光谱、荧光光谱的变化
FAOBlue以及香豆素衍生物的吸收光谱(左)和荧光光谱(右)。
FAOBlue在通过FAO转换成香豆素衍生物后,吸收最大值由350 nm变为405 nm的长波长。因此,在405 nm的激发条件下,FAOBlue不会发出荧光,只有在通过FAO释放香豆素衍生物时才会发出蓝色荧光。
※ 注意:
若使用处于FAOBlue的吸收最大值350 nm左右的光激发,FAOBlue也会发出蓝色荧光(380~450 nm;最大波长400 nm)。若在荧光显微镜中使用普通的DAPI滤光片,将会同时激发未反应的FAOBlue以及FAO反应后的香豆素衍生物。所以在选择滤光片时请格外注意。
可视化各种细胞类型中的FAO活性
在4种癌细胞中加入FAOBlue,培养一定时间后进行荧光观察。所有细胞都观察到了蓝色荧光,而添加FAO抑制剂etomoxir后荧光显著衰减,由此可知,蓝色荧光是由FAO活性引起的。
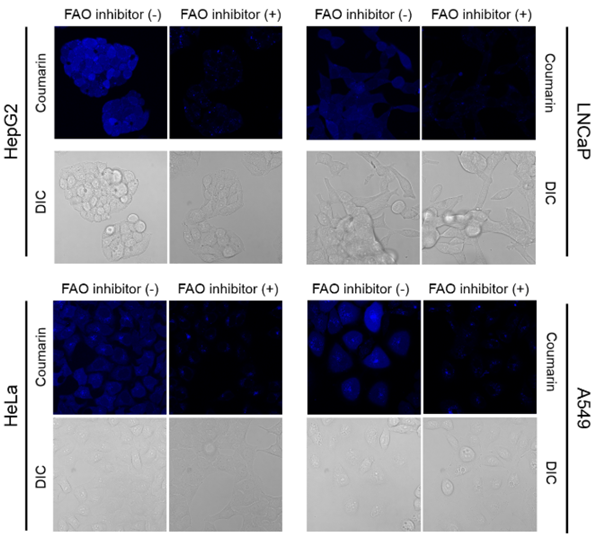
※ 各种细胞的实验条件有所不同。
※ HepG2 : 5 μM, 30 min
※ LNCaP: 20 μM, 120 min
※ HeLa : 20 μM, 120 min
※ A549 : 5 μM, 30 min
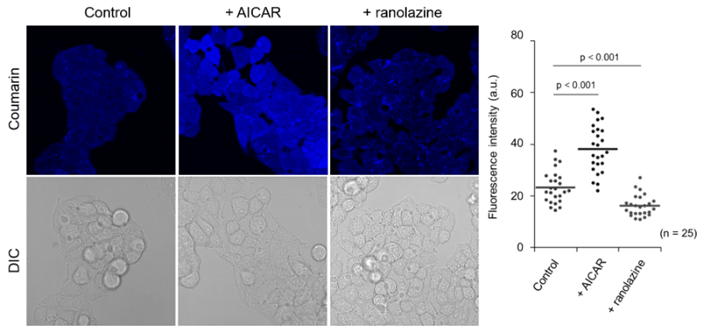
观察刺激依赖性β-氧化的变化
向HepG2细胞添加脂质代谢促进剂AICAR*2(200 μM,3 h)或部分FAO抑制剂ranolazine(200 μM,12 h)进行前处理后,添加FAOBlue(5 μM)培养30 min。进行荧光观察时,可以看到对比对照实验(未处理),AICAR中荧光强度明显增强,ranolazine中荧光强度明显降低。
*2 AICAR : AMPK(AMP-activated protein kinase)活化剂具有活化脂质代谢的功能。
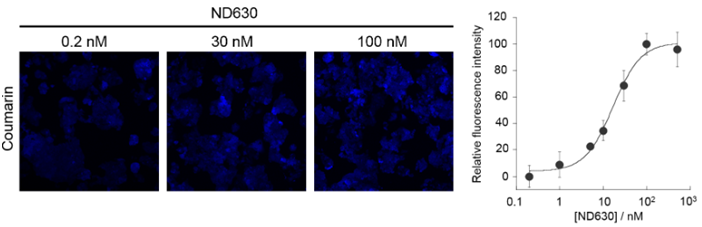
药物作用的定量分析
使用FAOBlue可以定量分析药物对FAO的效果。用非酒精性脂肪肝疾病(NAFLD)的候选治疗药ND-630(acetyl-CoA carboxylase inhibitor)前处理HepG2细胞4 h后,添加FAOBlue(5 μM)培养30 min。使用共聚焦激光显微镜评价蓝色荧光强度时,可以观察到依赖于ND-630浓度的荧光强度增加。由此可知,ND-630增强了FAO的活性。
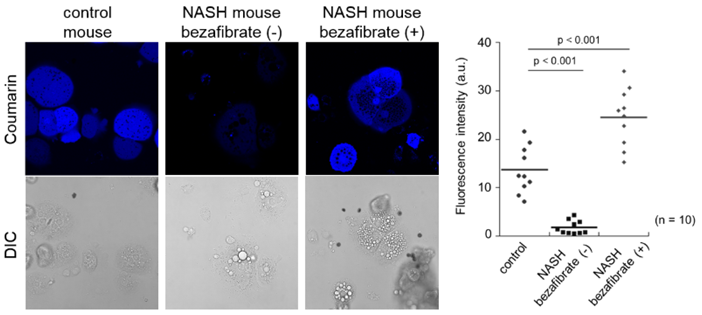
NASH模型小鼠分析
非酒精性肝炎(NASH)是一种与脂质相关的疾病,已知会降低脂肪分解的速度。向正常小鼠和NASH模型小鼠以口服形式给药增强脂质代谢的bezafibrate后,回收其肝脏制备初代培养肝细胞。向各个细胞加入FAOBlue(5 μM)观察其FAO活性,结果显示,对比正常小鼠来源细胞,NASH模型小鼠来源细胞的FAO活性明显被抑制。另一方面,我们可以看到给药bezafibrate的NASH模型小鼠来源细胞中FAO恢复了活性。
本试剂可用于脂质相关疾病模型中的FAO定量分析。
※ 本页面产品仅供研究用,研究以外不可使用。