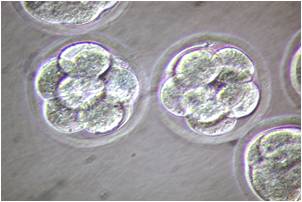
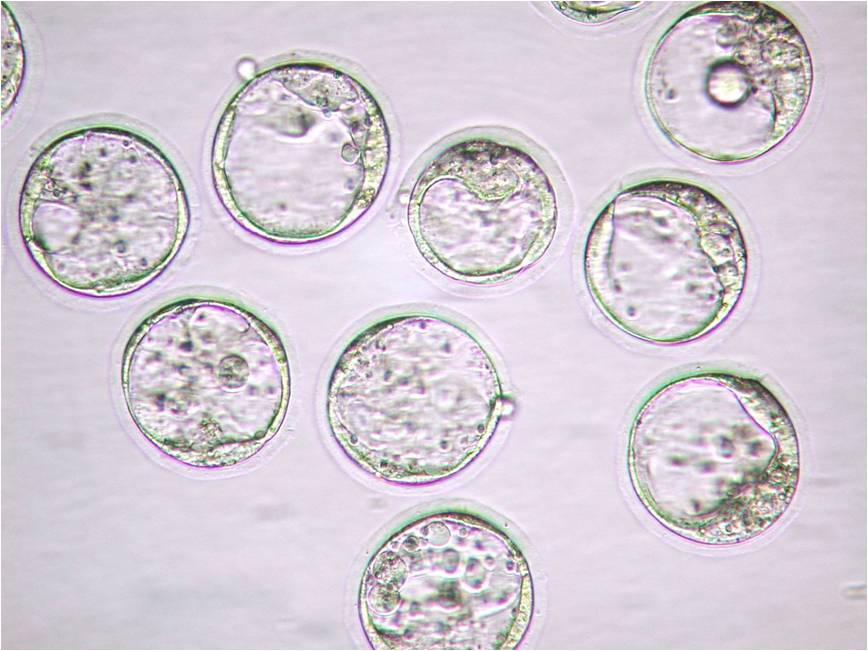
小鼠生殖工程学技术——5冻存运输小鼠2细胞期胚胎
 回到小鼠生殖工程学技术指南目录
回到小鼠生殖工程学技术指南目录

 回到小鼠生殖工程冻存及培养试剂
回到小鼠生殖工程冻存及培养试剂
◆材料
1. 2细胞期胚胎(新鲜或冻融复苏后的胚胎)
2. 培养皿(coring 35mm X 10mm Cat.No.430588)
3. 电动移液器(GILSON PIPETMAN P-200)
4. M2 Medium (Sigma Cat.No.M7167)
5. 0.5 mL EP管(Fisherbrand Flip Cap Microtubes 0.5 mL, Fisher Scientific Cat.No. FS-MCT-060-C)
6. 微管
7. KSOM/AA
8. 流动石蜡(Nacalai Tesque Cat.No.26137-85)
9. 纽扣式温度记录仪(KN Laboratories temperature data logger Samokuron G type)
10. CARD 冷藏运输试剂盒
o 纸盒(free-s1 Cat.No. 11-1585)
o 棉布
o 保温瓶(Thermos Co., Ltd. Cat.No.JMK-501)
o 冰袋(小)(Kyoritsu Co., Ltd. 冰袋雾凇 Cat.No. H-120)
o 冰袋(大)(shiro产业 冰袋R 500g 140 mm×250 mm、Cat.No. M250R-50)
o 泡沫箱(KARUX KC-3)
◆步骤
2細胞期胚胎的冻存
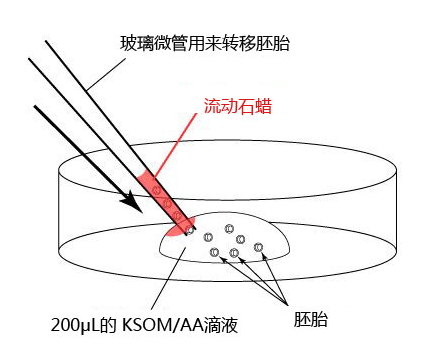
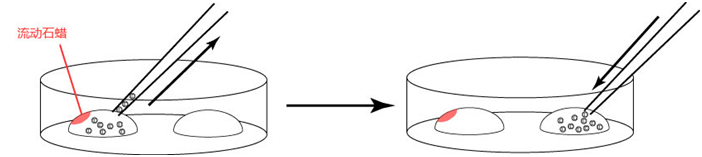
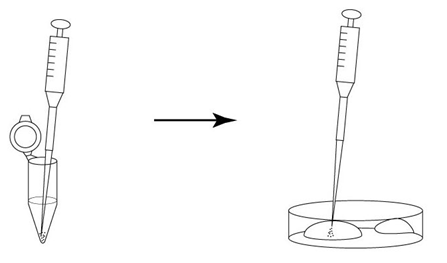
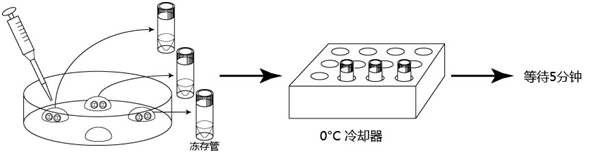
1. 用移液器(P-200)在培养皿上制作两个100μL M2的滴液(不要被流动石蜡覆盖)。
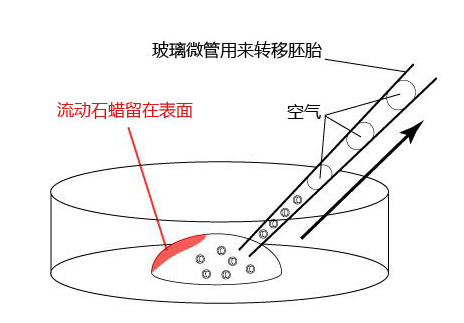
2. 把冻存的胚胎从被流动石蜡覆盖着的培养液里移至到一个M2滴液里。
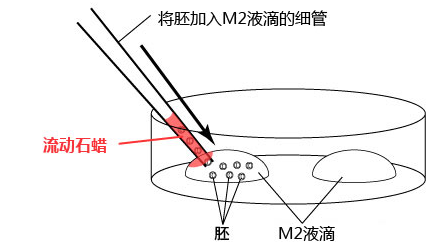
3. 更换新的微管,将胚胎从一个M2滴液移至另一个M2滴液里。
*把从被流动石蜡覆盖的培养液滴液移至制作好的M2滴液里的胚胎移至到另一个M2的滴液时,尽量避开附着流动石蜡的滴液位置。
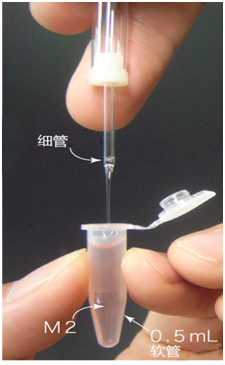
4. 往0.5mL EP管内加入0.6mL的M2。
*如果EP管顶部留有气泡时,需轻拍出气泡。

5. 从3个滴液里取出胚胎后放置在装满0.6mL的M20.5mL EP管底部(一只EP管能放40个2细胞期胚胎)。
* 移动胚胎后,在3个滴液里移液,确认微管里是否残留胚胎。
6. 合上EP管盖子,并用封口膜包封。
7. 在纸盒里装入EP管、纽扣式温度记录仪和棉布后,盖上盒盖紙箱。
M2、紙盒、EP管、纽扣式温度记录仪和棉布全在室温(20~25°C)下使用。

8. 纸盒保存在冷冻柜里(最长可保存72小时)。
2細胞期胚胎的冷藏运输
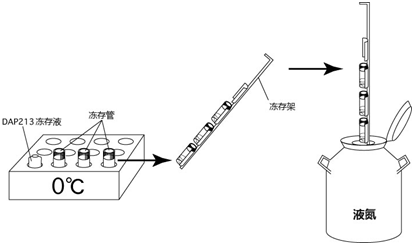
与上述冻存步骤一样,把EP管放进纸盒(2细胞期胚胎的冻存1~7步)后,按以下操作包装纸盒。
样品是常温的情况只需用保温瓶和小冰袋,4~8°C冻存的样品,则需要使用泡沫箱及大冰袋,包装时动作要迅速。
1. 把纸盒放进保温瓶内。

2. 再放进两个小冰袋至保温瓶内。

3. 紧紧盖上保温瓶盖。

4. 确认瓶盖盖紧后,在泡沫箱内铺上大冰袋,然后放入保温瓶(这时,请注意请勿倒放保温瓶里装有胚胎的EP管)。 接着,保温瓶两侧也放上大冰袋。最后用包装带固牢泡沫箱盖。

5. 用快递运送,整个泡沫箱保存在(4~8°C)冷冻柜里。
6. 用快递冻存运输最长保存时间可达72小时。
*冬季的室外气温会低至0°C以下,如果运输过程中泡沫箱长时间放置在室外,2细胞期胚胎就会死亡。寄方应首先联系附近的快递配送站,跟他们强调泡沫箱内放有活细胞,请注意切勿放置在室外。
更改 : 2013.03.06 放有2细胞期胚胎的纸盒与冰袋放进保温瓶的顺序互换,因为先放冰袋后放纸盒,使纸盒难以受到内外气温差的影响,原页面请点击此处。
从冷藏运输试剂盒里取出2期细胞胚胎
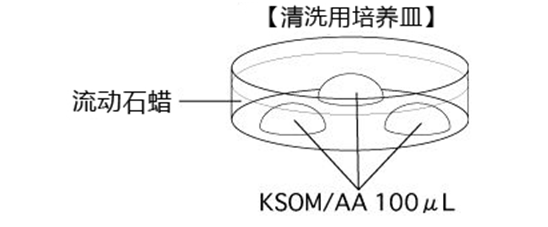
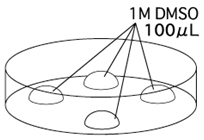
1. 注入3滴100μL 的KSOM/AA在培养皿上,然后用流动石蜡覆盖。把培养皿放入培养箱里孵育至少30分钟。
2. 从保温瓶里取出放有样品的纸盒。
3. 纸盒在室温下放置30分钟。
注意: 胚胎将在30分钟内沉在EP管底部。
4. 打开纸盒,轻轻地取出棉花,一旦取出棉花后,要拿起装有胚胎的EP管,并打开盖子。
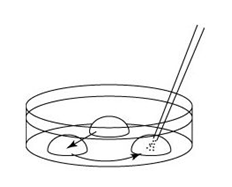
5. 用灌注凝胶枪头收集EP管中M2上清液200μL,然后转移到培养皿的边缘。
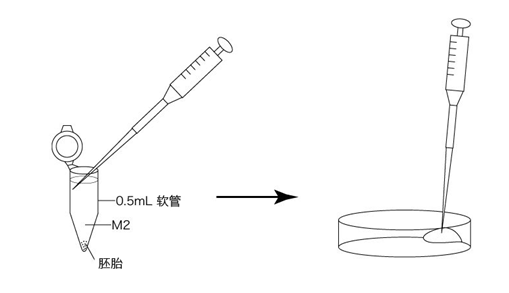
6. 用灌注凝胶枪头小心地把全部M2包括在EP管底部的胚胎移至培养皿的中心。
注意: 为了方便操作,在使用移液器时尽量避免吸入空气。
7. 从M2里采集的胚胎,分别转移至3个100μL KSOM/AA 滴液中,进行清洗。
注意: 如果不能移走所有的胚胎,可以用培养皿边缘上的200μL M2滴液来清洗EP管内部。
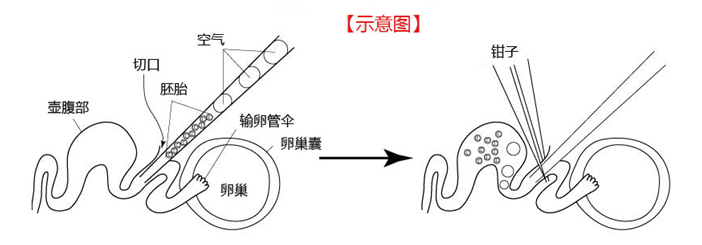
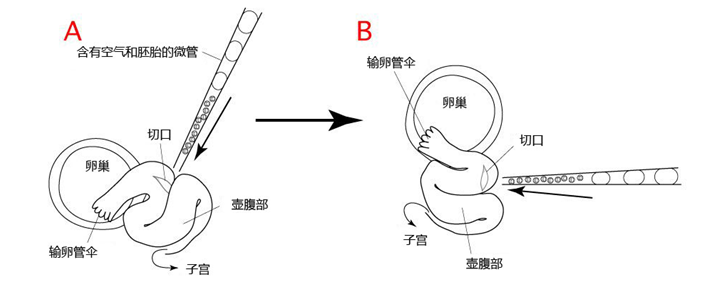
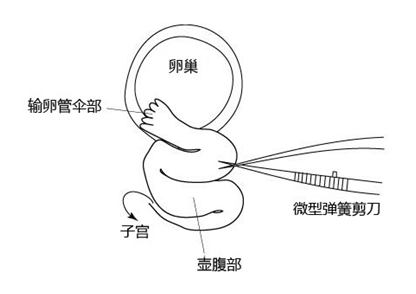
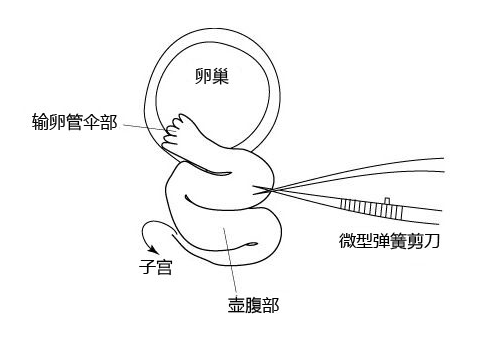
8. 然后把胚胎移植到代孕小鼠的输卵管内。
注意: 理论上,在胚胎清洗完至移植到代孕小鼠体内的这一过程需在短时间内完成。 (请参考“胚胎移植入输卵管”)




 →clip applicator
→clip applicator