外泌体与肿瘤细胞转移及恶化的关联

东海大学综合医学研究所造血领域 东海大学医学部血液肿瘤内科 樋口广士、幸谷爱
◆前言
肿瘤的形成和恶化过程不仅与肿瘤细胞彼此间的相互作用有关,还和肿瘤细胞和正常细胞所构成微环境的相互作用有关。例如,从很早开始科学家们就观察,在很多的肿瘤组织中浸润着正常的免疫细胞,而临床认为慢性炎症会增加产生肿瘤的风险。此外,有报告显示成纤维细胞和内皮细胞等细胞构成的肿瘤微环境,有助于肿瘤细胞的增殖。
大多数以根治肿瘤细胞为目标的治疗方法,不仅对正常细胞有很强的毒性,其副作用还会对身体产生极大的负担。而且,由于染色体不稳定的肿瘤细胞容易获得耐药性,病情反复发作时药物无效也是一个很大的问题。对此,破坏由正常细胞构成的微环境又或者对其进行适当的控制来根治肿瘤的治疗策略备受瞩目1)。
本文对细胞外泌体和肿瘤细胞转移及其恶化的关联进行了介绍,同时也对Epstein-Barr病毒(EBV)阳性恶性淋巴瘤中外泌体的活动情况进行了概述。
◆细胞外囊泡外泌体是什么?
生物体内所有的细胞都是通过直接接触或者细胞因子、趋化因子等分泌蛋白来进行信息传递的。近年来,作为担任这种细胞间信息传递的新因子,细胞外囊泡受到了大家的关注。科学家发现,细胞外囊泡和细胞一样,由脂质双层膜构成,包含蛋白,核酸、脂质等多种物质,同时细胞外囊泡还能传递这些分子中包含的信息2)。
外泌体是细胞外囊泡中直径较小(50~200nm),从核内体的多胞体(MVB:multi-vesicular body)中释放而出。以前通常采用超速离心法或者密度梯度离心法来分离外泌体,但是采用这些方法很难完全去除外泌体中来自细胞本身的杂质。为了更进一步地研究外泌体,我们一直在寻找能分离出更高纯度外泌体的方法。作者利用和光纯药研发的新型外泌体提取试剂盒,尝试进行了外泌体的分离实验。该试剂盒中的试剂能够亲和外泌体表面的磷酯酰丝氨酸,从而实现外泌体的分离。用以前的超离心方法分离出的外泌体和使用本试剂盒分离出的外泌体在电子显微镜下观察图像如图1所示。使用超离心法提取的外泌体中混入了很多杂质,使用本试剂盒则成功分离出高纯度的外泌体。我们期待今后这种亲和提取方法能成为一种分离外泌体的标准方法。
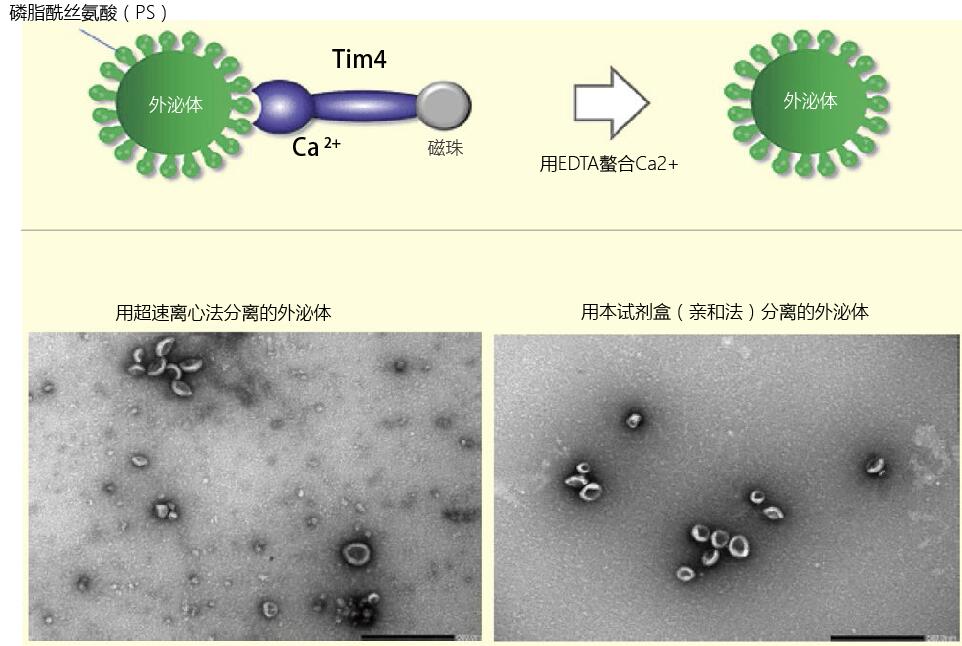
图1.使用不同分离法时外泌体纯度的比较
◆外泌体和肿瘤的转移和恶化
自2007年发现外泌体中含有miRNA后3),科学家开展了很多通过外泌体进行生物分子运输和其生物学意义的研究。特别是根据“肿瘤细胞会分泌更多的外泌体”、“外泌体中含有肿瘤特异性抗原,而外泌体能运输这些抗原”等的研究,外泌体作为一种新的诊断和治疗的靶标受到广泛的关注。为了显示肿瘤外泌体在微环境中的活动会促使肿瘤转移和恶化,本文将为大家介绍几个相关研究成果。
肿瘤在转移到其他组织时,需要在间质细胞间移动并到达血管中。科学家们发现,在这个过程中,外泌体通过纤维连接蛋白促进肿瘤细胞的运动性,再通过MT1-MMP蛋白酶促进细胞外基质的分解、血管新生及血管渗透性,来促进肿瘤转移4-7)。此外,还发现了多数的肿瘤细胞对转移的组织具有指向性,而外泌体表面的整合素就是决定其指向性的因子。这些报道表明,αvβ5整合素决定了对肝脏、α6β4・α6β1整合素决定了对肺部的指向性8)。这些报告是以外泌体为中心的肿瘤细胞-微环境之间复杂交流极其重要的报告。
在上述报导的基础上,以下是作者团队独自就EBV阳性淋巴瘤中外泌体作用进行研究的概述。
◆Epstein-Barr病毒(EBV)和恶性淋巴瘤
Epstein-Barr病毒(EBV)是从Burkitt淋巴瘤培养细胞中分离的最初的人体癌症病毒。CD21被认定为感染性受体,在试管中容易引起B细胞的转化。由此我们知道EBV编码的LMP(latent membrane protein)及 EBNA (EBV nuclear antigen)等9种基因控制了细胞内信号和转录因子的活性,导致了感染细胞的永生化和形态转化。
现在,世界上90%的人口都携带EBV,即处于潜伏感染状态,当由于各种各样的原因导致免疫力低下时,会引发B细胞性・T/NK细胞性淋巴瘤,极少数情况下还会引发鼻咽癌或胃癌等上皮细胞肿瘤。有报告显示在部分的B细胞性淋巴瘤里,用传统的方法进行治疗时,EBV呈阳性的病例比EBV呈阴性的病例治疗效果差,出现预后不良。人们强烈希望研发出针对EBV阳性淋巴瘤、替代现有治疗方法的特效新疗法。作者鉴于EBV阳性疾病治疗的现状,以EBV阳性淋巴瘤的发病及恶化的机制为核心进行了研究。
重要的一点是,EBV阳性淋巴瘤组织中浸润了很多免疫细胞,而肿瘤细胞依靠炎症微环境来生存。作者着眼于这点,对EBV阳性淋巴瘤外泌体对微环境的影响以及作为促进淋巴瘤恶化因子的EBV源miRNA活动情况进行了分析。
◆外泌体运送EBV来源的miRNA
EBV自身的染色体组上被称为BART(BamHI-A rightward transcripts)的领域里有编码miRNA簇。这个簇中编码了大约40种的miRNA,也有人称之为BART miRNA,本文统一称为EBV miRNA。现在,这些EBV miRNA在淋巴瘤发病和恶化中的作用还存在很大的争论。例如,有研究显示EBV miRNA抑制细胞凋亡有助于肿瘤生存,也有研究报道显示维持EBV的潜伏状态可以抑制肿瘤化9)。
在此类研究中,Pegtel团队的研究发现,EBV阳性淋巴瘤细胞分泌出的外泌体中含有EBV miRNA10)。这份报告表明了外泌体选择性进入人单核细胞来源的树突状细胞(MoDC),并运送EBV miRNA。从该结果可知,EBV阳性淋巴瘤中的外泌体对肿瘤组织中浸润的非肿瘤细胞的活性有一定影响,还能导致微环境的改变。
◆外泌体对淋巴瘤发病的影响
在Pegtel团队的研究的基础上,作者尝试进行同样的实验时,证实了淋巴瘤中的外泌体会选择性进入单核细胞/巨噬细胞。我们发现含有大量EBV miRNA的外泌体能促进巨噬细胞中TNFα和IL-10等基因的表达。这种基因的表达模式和在肿瘤微环境中浸润的TAM(Tumor-associated macrophage)非常相似,所以吸收含有EBV miRNA的外泌体的巨噬细胞可能在微环境的构成中发挥重要的功能。
接着,为了确认EBV阳性淋巴瘤中的外泌体能促进微环境构建,作者利用了EBV感染的小鼠模型。本来,EBV只会感染以人类为首的灵长类动物,但将人类脐带血中CD34阳性造血干细胞移植到免疫缺陷NOG小鼠上,如此可建立由EBV感染引发的淋巴瘤发病的小鼠模型。这个小鼠模型在被野生型EBV株(Akata)和EBV miRNA缺损株(B95-8)感染后,感染野生型株的小鼠预后较差,但感染miRNA缺损株的小鼠恢复情况良好。对此,作者尝试对感染miRNA缺损株的小鼠静脉注射含有miRNA的外泌体,发现小鼠竟然产生了淋巴瘤,而且肿瘤组织中浸润着大量的巨噬细胞。最后我们还发现,注入氯膦酸盐脂质体去除肿瘤中巨噬细胞的同时,肿瘤细胞也会减少。
上述结果表明,在EBV阳性淋巴瘤恶化的过程中,外泌体能利用巨噬细胞构建有利于肿瘤细胞的微环境。
◆结语
外泌体在刚被发现时,曾被认为是把多余的蛋白和核酸释放到细胞外的一种结构。但如今作为诊断和治疗以肿瘤为主的各种疾病的靶标而备受关注。本文着重介绍了肿瘤中外泌体的功能,并认为外泌体会参与到所有的生命现象中。虽然大多数的研究都已明确了外泌体的生物学意义,但其详细的功能还存在很多未知的部分。希望我们的研究能有助于今后对外泌体的研究。
【参考文献】
[1] Quail, D. F. and Joyce, J. A. : Nat. Med ., 19 (11), 1423(2013).
[2] Tkach, M. and Thery, C. : Cell , 164, 1226 (2016).
[3] Valadi, H. et al . : Nat. Cell Biol ., 9(6), 654 (2007).
[4] Sung, B. H. et al . : Nat. Commun ., 6, 7164 (2015).
[5] Hoshino, D. et al . : Cell Rep ., 5, 1159( 2013).
[6] Kosaka, N. et al . : J. Biol. Chem ., 285( 23), 17442( 2010).
[7] Zhou, W. et al . : Cancer Cell , 25, 501( 2014).
[8] Hoshino, A. et al . : Nature , 527, 329( 2015).
[9] Ok, C. Y. et al . : Blood , 122( 3), 328( 2013).
[10] Pegtel, D. M. et al . : PNAS , 107( 14), 6328 (2010).
Tim4蛋白亲和法分离高纯度外泌体的提取试剂盒!!
MagCaptureTM Exosome Isolation Kit PS
本试剂盒能从细胞培养上清及血清等样本中,通过亲和法轻松地分离出高纯度的外泌体。在外泌体膜囊表面的磷脂酰丝氨酸(PS)上使用结合了钙离子的Tim4蛋白,再通过螯合剂洗脱得到完整的外泌体。
◆特点
● 所有分离外泌体所需的试剂整合到一个试剂盒中,方便使用
● 能从培养上清、血清中分离出高纯度的外泌体
● 无需采用超速离心法,操作简单,能同时处理多个样本
● 能分离完整分外泌体,有助于开展下一步研究
● 回收效率高于超速离心法
● 还能用于提取微囊泡等细胞外囊泡
◆试剂盒组成
● Streptavidin Magnetic Beads …………600μL×1
● Biotin-labeled Exosome Capture ………100μL×1
● Exosome Capture Immobilizing Buffer ..35mL×1
● Exosome Binding Enhancer( ×500) … 500μL×1
● Washing Buffer ………………………… 75mL×2
● Exosome Elution Buffer ……………………5mL×1
● Reaction Tubes …………………………………22支
◆产品信息
|
产品编号
|
产品名称
|
规格
|
包装
|
|
299-77603
|
MagCaptureTM Exosome Isolation Kit PS
|
基因研究用
|
2次用
|
|
293-77601
|
10次用
|
◆相关商品
|
产品编号
|
产品名称
|
规格
|
包装
|
|
297-79201
|
PS CaptureTM Exosome ELISA Kit(Anti Mouse IgG POD)
|
基因研究用
|
96次用
|
欲了解更多相关产品请点击文字:MagCapture™ 外泌体提取试剂盒










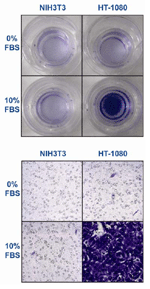 的一类;2、粘附分子,是一类参与细胞间或细胞与间质相互作用的细胞表面结构。由四个超家族组成—整合素,钙粘连素,免疫球蛋白,选择素;3、趋化因子,细胞外基质、基底膜是肿瘤转移的一道屏障,它们由纤维结合素、层粘连蛋白、玻璃体结合蛋白、Ⅳ型胶原、弹性蛋白组成。一旦降解释放出来就会起到趋化因子的作用,导向释放的部位;4、胞外基质降解酶,为蛋白水解酶可降解基质。常见的有基质金属蛋白酶(MMP),胞浆酶,尿激酶纤维蛋白溶酶原激活因子(uPA),组织蛋白酶;5、血管形成因子。血管形成本身就有一定的侵蚀性,肿瘤细胞可以沿着新生血管所开启的胶原裂隙侵蚀,因此血管形成是肿瘤侵袭的一个条件。
的一类;2、粘附分子,是一类参与细胞间或细胞与间质相互作用的细胞表面结构。由四个超家族组成—整合素,钙粘连素,免疫球蛋白,选择素;3、趋化因子,细胞外基质、基底膜是肿瘤转移的一道屏障,它们由纤维结合素、层粘连蛋白、玻璃体结合蛋白、Ⅳ型胶原、弹性蛋白组成。一旦降解释放出来就会起到趋化因子的作用,导向释放的部位;4、胞外基质降解酶,为蛋白水解酶可降解基质。常见的有基质金属蛋白酶(MMP),胞浆酶,尿激酶纤维蛋白溶酶原激活因子(uPA),组织蛋白酶;5、血管形成因子。血管形成本身就有一定的侵蚀性,肿瘤细胞可以沿着新生血管所开启的胶原裂隙侵蚀,因此血管形成是肿瘤侵袭的一个条件。
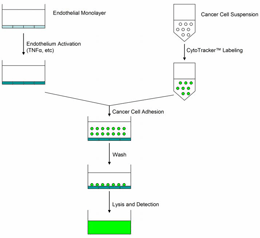 过血管或淋巴管,癌细胞会被带到身休的某一部位且停驻下来,少数肿瘤细胞能生存下来,并在新的部位里面繁殖和增长,逐渐形成转移瘤。恶性肿瘤细胞有多种转移方式,淋巴道和血道转移是常见的方式,种植性转移也是一种转移途径。
过血管或淋巴管,癌细胞会被带到身休的某一部位且停驻下来,少数肿瘤细胞能生存下来,并在新的部位里面繁殖和增长,逐渐形成转移瘤。恶性肿瘤细胞有多种转移方式,淋巴道和血道转移是常见的方式,种植性转移也是一种转移途径。