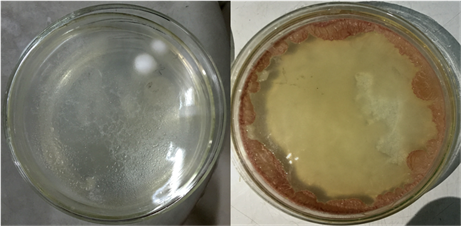
植物组织培养是20世纪初发展起来的一门新兴技术,随着这项技术的日益完善,其应用也越来越广泛。但是在组织培养过程中,常常会遇到污染问题使实验无法进行下去,甚至导致整个实验失败,给科研和工厂化生产带来损失。
污染是指在植物组织培养过程中,培养基和培养材料滋生杂菌,最终导致培养失败的现象。常见的污染类型包括:由霉菌引起的真菌性污染、多由外植体带菌引起的细菌性污染、长期多次继代引起的内生菌污染以及农杆菌污染等。面对植物组培污染问题,我们通常采取在培养基中加入适量的抗生素(如青霉素、链霉素、氯霉素等)来抑菌。但是抗生素一般不稳定,遇酸、碱或加热都易分解而失去活性。而且单一抗生素抑菌容易产生抗药性,一旦停止使用,污染率就会显著上升。同时,高浓度的抗生素会影响植物的生长。
 图片1
图片1
为解决上述问题,我们推荐专业植物组培高效广谱性抗菌剂PPM™,它可以有效预防和清除由于空气、灭菌不彻底、交叉污染、外植体消毒等各种原因导致的植物组培苗的真菌、细菌、内生菌和农杆菌污染。可以加入培养基高温灭菌;而且在合理使用剂量下,不会对植物的生长产生任何影响。
使用方法如下:
1、 常规污染预防用量:
一般推荐使用浓度为0.05%-0.2%(1L培养基中加入0.5-0.75ml PPM™);愈伤增殖, 器官形成,胚性组织发育等使用浓度为0.05%-0.075%。
2、 植物内生菌污染处理:
种子:PPM™不推荐用于直接处理含有大量的细菌或真菌孢子的种子灭菌;对于种子离体萌发,建议先采用传统方法消毒,然后置于含 2-3%PPM™的全培养基础盐溶液中,轻轻搅拌4-12小时,此过程千万不能添加Tween20和调节pH,处理完成以后直接插入含有 PPM™(草本植物0.05-0.1%,木本植物0.2%)的培养基里进行培养。
外植体::以 1cm 外植体为例,将外植体置于含 4-5%PPM™的全培养基础盐溶液中,轻轻搅拌4-12小时,此过程千万不能添加 Tween20和调节pH,处理完成以后直接插入含有PPM™(草本植物 0.05-0.1%,木本植物0.2%)的培养基里进行培养。
块茎,球茎和鳞状物的观赏植物样本:将其整体放入消毒剂中搅拌消毒处理以后, 用水冲洗干净,将材料切成薄片,置于含 4-5%PPM™的全培养基础盐培养液中,轻轻搅拌4-12小时,此过程千万不能添加Tween20 和调节pH,处理完成以后无需冲洗直接插入含有 0.1-0.2%的PPM™的培养基里进行培养。
3、 如果厚的外植体、污染严重的植株、种子等样本经过以上处理仍得不到理想效果,可尝试以下操作:
将材料浸泡在水中持续搅拌处理(松软组织搅拌1小时,硬实组织搅拌2小时)
将材料在含50%的PPM™全培养基础盐溶液中搅拌处理5-10分钟,此过程千万不能添加 Tween20 和调节pH
无需冲洗,将处理过的材料直接加入到培养基中即可。对于真菌污染,可在培养基中加入适当浓度的PPM™。对于真菌细菌混合性污染,建议在培养的第一个月的培养基中加入0.05%-0.2%的PPM™
4、 严重污染材料污染去除与抢救(重污染不超过一周)
将污染的材料至于流水中用软刷刷洗,然后置于含50% PPM™的无菌水溶液中搅拌5-15分钟;对于细菌或者混合性污染,建议使用 100% PPM™与 0.6g/L 的柠檬酸无菌水溶液按 1:1 混合的低 pH(2.8-3.2)的酸性溶液处理
处理后的材料无需清洗,直接插入含0.05%-0.25的PPM™的培养基中培养至少一个月以上,其中前10天需要弱光培养
5、 农杆菌的去除
共培养以后,将样本用无菌水清洗,然后将样本浸没在 100% PPM™(补充4X的培养基盐溶液)中处理2分钟,取出后用无菌纸吸干后并置于常用抗性培养基中培养,3 周后,更换到只含有0.05%-0.075% PPM™(无常用抗生素)的培养基中培养。
 图片2
图片2
注意事项:
在所有 PPM™消毒处理外植体的过程中,尽量保证容器的体积足够大,并使外植体材料所有面积与含PPM的处理溶液充分接触,以保证消毒效果;
如果外植体出现高度氧化现象,不要扔弃,大约50%的外植体在 4-6 周内即可恢复
50% PPM™ 的处理溶液可以重复使用但是不推荐,因为使用次数和效果受外植体的体积与接种密度的影响。将50% PPM™的处理溶液保存在4ºC可适当延长其活性,一般可使用不超过10次。如果必要,建议配制2份50% PPM™溶液,一份用于外植体消毒内生菌污染,另一份用于消除“培养过程中”的轻度污染材料抢救,第二份溶液在每次处理过后需要用 0.2mm滤器过滤
如果50%PPM™溶液处理效果不理想,可采用100%PPM™溶液进行处理,处理方法相同,但使用次数不得超过10次。
产品信息:
 图片3
图片3
产品已发表文献:
- Miyazaki J, Tan BH, Errington SG. Eradication of endophytic bacteria via treatment for axillary buds of Petunia hybrida using Plant Preservative Mixture (PPMTM). PCTOC. 2010;102(3):365-372.
- Miyazaki J, Tan BH, Errington SG, Kuo JS. Bacterial endophyte in Macropidiafuliginosa: its localisation and eradication from in vitro cultured basal-stem callus. Aust J Bot. 2011;59(4):363-368.
- Lata H, Chandra S, Khan IA, ElSohly MA. Propagation through alginate encapsulation of axillary buds of Cannabis sativa L. — an important medicinal plant. Phys and Mol Biol of Plants. 2009;15(1):79-86. 4. Greer SP, Rinehart TA. Dormancy and Germination In Vitro Response of Hydrangea macrophylla and Hydrangea paniculata Seed to Light, Cold-Treatment and Gibberellic Acid. J. Environ. Hort. 2010;28(1):41–47.
- Greer SP, Rinehart TA. Dormancy and Germination In Vitro Response of Hydrangea macrophylla and Hydrangea paniculata Seed to Light, Cold-Treatment and Gibberellic Acid. J. Environ. Hort. 2010;28(1):41–47.
- Moghaddam S, et al. Optimization of an Efficient Semi-Solid Culture Protocol for Sterilization and Plant Regeneration of Centellaasiatica (L.) as a Medicinal Herb. Molecules. 2011;16(11): 8981-8991
- Çolgecen H, Koca U, Toker G. Influence of diff erent sterilization methods on callus initiation and production of pigmented callus in ArnebiadensifloraLedeb. Turk J Biol. 2011; 35:513-520
- Pouvreau J, et al. A high-throughput seed germination assay for root parasitic plants. Plant Methods 2013;9:32
- Marecik R, Bialas W, Cyplik P, Lawniczak L, Chrzanowski L. Phytoremediation Potential of Three Wetland Plant Species Toward Atrazine in Environmentally Relevant Concentrations. Pol. J. Environ. Stud. 2012;21(3):697-702
- Pérez Flores J, Aguilar Vega ME, Roca Tripepi R. Assays for the in vitro establishment of Swietenia macrophylla and Cedrelaodorata. Rev. Colomb. Biotecnol. 2012;14(1)
- Nesterenko-Malkovskaya A, Kirzhner F, Zimmels Y, Armon R. Eichhorniacrassipes capability to remove naphthalene from wastewater in the absence of bacteria. Chemosphere. 2012;87(10):1186-1191.
- Kieffer M, Fuller MP. In Vitro Propagation of Cauliflower Using Curd Microexplants. Meth Mol Biol. 2013;994:329-339.
- Kodym A, Temsch E, Bunn E, Delpratt J. Ploidy stability of somatic embryo-derived plants in two ecological keystone sedge species (Lepidospermalaterale and L. concavum, Cyperaceae). Aust J Bot. 2012;60(5):396-404.
- Peña-Ramírez YJ, et al. Induction of somatic embryogenesis and plant regeneration in the tropical timber tree Spanish red cedar [Cedrelaodorata L. (Meliaceae)]. PCTOC. 2011;105(2):203-209.
- Haddadi F, Adb Aziz M, Saleh G. Abd Rashid A, Kamaladini H. Micropropagation of Strawberry cv. Camarosa: Prolific Shoot Regeneration from In Vitro Shoot Tips Using Thidiazuron with N6-benzylamino-purine. HortScience. 2010;45(3):453-456.
- Jimenez VM, Castillo J, Tavares E, Guevara E, Montiel M. In vitro propagation of the neotropical giant bamboo, Guadua angustifolia Kunth, through axillary shoot proliferation. PCTOC. 2006;86:389–395.
- Compton ME, Koch JM. Influence of Plant Preservative Mixture (PPM) on adventitous organogenesis in Melon, Petunia, and Tobacco. In Vitro Cell. Dev. Biol.- Plant. 2001;37:259-261
上海金畔生物科技有限公司是美国Plant CellTechnology中国代理,为用户提供完善的技术支持与售后服务。





 图片1
图片1
 图片2
图片2 图片3
图片3