通往定量NMR之门-用qNMR方法进行精确检测

和光纯药工业股份有限公司 化成品研究所 三浦亨
qNMR法大致分为内标法和外标法两种。在样本溶液中添加作为内标的qNMR用标准物质进行检测的方法是内标法。相应的,外标法就是先准备一份溶解了一定量qNMR用标准物质的已知浓度的标准溶液,再分别检测样本溶液和标准溶液的定量方法。外标法最大的优点是不需要往样本中添加qNMR用标准物质,样本在使用后可直接回收。虽然内标法和外标法的检测参数基本相同,但在使用外标法检测纯度和含量时,还须考虑由于计算公式不同而需要校正的项目及核磁管不同等问题,所以外标法在操作上比内标法复杂。因此,研究者普遍认为外标法比内标法更难保证检测的精确度。
所以,这次我们根据日本药典采用的内标准法的检测流程,为大家介绍一下用qNMR进行精确检测时的要点。内标法的检测流程如Figure1所示。流程非常简单,主要分为样品制备,NMR检测和数据分析三部分。实际上,按照这些操作只要将天平称出的样品质量和NMR谱图的信号面积数值代入Figure2的计算公式中,就能得出分析结果。一听到qNMR我们很容易会认为只要正确地进行NMR检测就可以了,但实际上如果在样品制备、NMR检测、数据分析任一部分没有按适当的方法进行的话,最终很难得出精确的检测结果。
下面将按各部分逐一为大家介绍qNMR检测的要点。
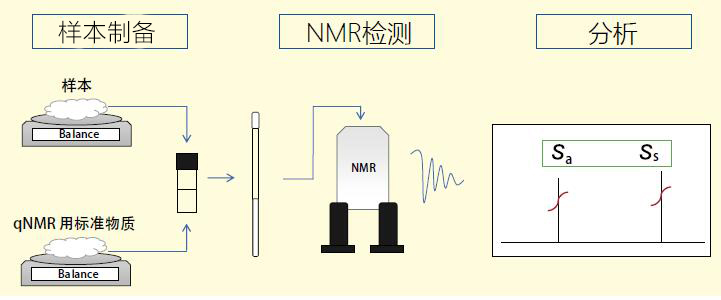
Figure1 内标法的检测流程概况图

Figure2 计算公式
◆样品制备
在qNMR的操作中十分容易被轻视的一步就是样品制备。长期操作NMR的人可能觉得样品制备就是将所有试剂混合在一起,但实际上这是一步很重要的操作。Figure3展示了日本药典(E)-肉桂酸qNMR纯度规定的样品制备方法1)。其中规定了样品制备时要使用超微量天平(日本药典上写的是“超微量化学天平”),其原因是要精确地称量出几毫克的样品及qNMR用标准物质,如果不使用这种高精确度的天平是很难得出准确的称量结果的。另外,美国药典(United States Pharmacopeia;USP)的最小称量值(minimum weight;W min)作为天平称量刻度的参考值。满足天平称量要求精确度的下限值,称量质量大于最小称量值,这样的刻度才可行。如下面Eq.(1)所示,重复10次称量毛重(样品称量容器为铝称量盘(约60mg))得到标准差(standard deviation;SD)σ,乘以扩展因子2与称量值的不确定度0.1%相除得到的数值2000(=2/(0.10/100)),可以得出最小称量值Wmin2)。我推荐大家也试着测一下平常经常使用的天平的最小称量值。Wmin=σ× 2000 Eq.(1)
另外,样品制备时还需注意要使用的qNMR用标准物质。最近,我们公司上架了多种能用作qNMR用标准物质的产品,其中较为理想的是使用确保了国际单位制(International System of Units;SI)中可追溯的(这里是指物质的量(摩尔:mol))认证标准物质(Certified Reference Material;CRM)的标准品。qNMR的检测原理是由NMR谱图 计算出物质的量,比较已知的标准物质的信号面积和样品的信号面积,计算出样品的物质的量的方法,因此qNMR用标准物质,建议大家使用根据SI可溯源的纯度精确的认证标准物质。使用高纯度物质,称量稳定准确,信号的数量或者自旋耦合的影响下信号分裂少,在特定的环境中会使其发生化学位移、在氘代溶剂中稳定且不和样品反应、qNMR用标准物质要求对氘代溶剂有良好的溶解性3)。在样品制备时还有一些其他注意事项,如使用的 氘代试剂本身的信号不能与被分析对象的信号重叠,样品和qNMR用标准物质要完全溶解于氘代溶剂中,等等。对于前者,建议用只有氘代溶剂的NMR谱图作为空白值进行确认。对于后者,溶剂种类、温度、pH值等不同的条件下,溶剂的溶解性也不同,需要有关溶解性的信息才能详细讨论。

Figure3.日本药典(E)-肉桂酸qNMR纯度规定的样品制备
出处:《第十七版日本药典》(厚生劳动省)
◆NMR检测
qNMR使用的NMR检测条件,我参考了日本药典规定的qNMR的测试条件。参考Figure4所示的日本药典(E)-肉桂酸qNMR的测试条件,为大家介绍有关NMR检测条件的要点1,4)。①设备设定1H共振频率在400MHz以上。NMR的灵敏度和分辨率会随着外部磁场的增强而提高,为了得到足够的灵敏度和分辨率,设备的1H共振频率设定在400MHz以上。建议选择符合测量目的(作为目标的精度等)的设备的共振频率。②数字分辨率要设定在0.25Hz以下。获得NMR信号作为第一个模拟信号,然后变为数字信号(以脉冲FT-NMR为前提)。这时,如果数据选取点数很少的话,傅里叶变换后的NMR光谱中不能重新出现正确的信号的形状。为了有足够的数字分辨率使信号的形状重新出现,所以日本药典将数字分辨率设定在0.25Hz以下。③将旋压设为关闭(样本试管无旋转),是为了避免旋转样本试管时出现的旋转边带可能会和作为定量分析的对象的信号重合。④脉冲角度设定为90°是因为在单位时间上的灵敏度良好,且累计的效率高。⑤设定13C核解耦。13C核解耦是消除由和13C核的自旋耦合产生的微小的信号分裂(13C卫星边带)的方法。13C卫星边带的目的是防止与作为定量分析的对象的信号重叠,而出现不能得到精确的信号面积的情况。⑥延迟时间设定为脉冲重复等待时间60秒以上。延迟时间是脉冲序列中从第一次脉冲开始到下一次累计中相同的脉冲等待时间。在定性检测中一般使用的延迟时间是5秒左右,但在qNMR中为了防止信号面积的饱和,以有效数字超过两行的定量精确度为目标时,必须将延迟时间设为纵向弛豫时间(spin-lattice relaxation time、T 1)的7倍以上5)。在日本药典里,由于普通的化合物的T1最长也只在7秒左右,所以为了充分地确保延迟时间为纵向弛豫时间的7倍,就把延迟时间定为60秒以上。

Figure4.日本药典规定的(E)-肉桂酸qNMR纯度的测试条件
出处:《第十七版日本药典》(厚生劳动省)
◆数据分析
下面要说的是在进行数据分析时的要点。
首先必须注意窗口函数的处理。窗口函数就是傅里叶变换FID信号时,为改善光谱的灵敏度或线宽而相乘的函数。我们能根据窗口函数处理加工符合目的的光谱,但另一方面,不当的窗口函数处理会导致丧失信号面积精确度。qNMR中除了验证精确度时,其他都不进行窗口函数处理。零填充处理是补充数据选取点,使光谱的形状变平滑的步骤,它能提高信号面积的精确度,所以建议在数据分析时进行这一步操作。而且,零填充处理是一种在得出的FID信号后面补充一个强度为零的数据选取点,提高数字分辨率的方法。另外,由于NMR信号的相位在获得NMR信号之前是不明确的,所以需要在检测后与相位符合,这步操作就叫相位校正。我们能通过分析软件自动进行NMR信号的相位校正,但这样会产生很多相移。在qNMR中,相移是造成信号面积偏差的原因,需要通过手动操作来消除相移6)。很多时候NMR光谱的基线强度不一定为零。这是在获得信号面积时产生偏差的原因,所以在qNMR中建议进行基线校正。基线校正有很多种算法,在qNMR中,建议利用被看作基线的数据选取点作为校正点,进行基线的平坦处理。还需要注意避免出现下面情况:根据已选的算法,利用信号末端的一部分的数据选取点作为校正点,结果信号形状受到很大影响,信号面积发生剧变。基线校正会对信号面积产生很大的影响,所以一定要按照规定的规则谨慎进行。
下次我会围绕实际中测量的例子再和大家进行探讨。
【参考文献】
[1] The Japanese Pharmacopoeia, Seventeenth Edition (E )-Cinnamic acid for assay 2( Purity value by quantitative NMR).
[2] USP“ General Chapter 41 Balances”, US Pharmacopeia USP 39-NF 34(2016).
[3] Miura, T., Sugimoto, N., Suematsu, T., Millis, K. K., Asakura, K. and Yamada, Y. : New Horizons of Process Chemistry , 275- 285( 2017).
[4] Hosoe, J., Sugimoto, N., Suematsu, T., Yamada, Y., Miura, T., Hayakawa, M., Suzuki, H., Katsuhara, T., Nishimura, H., Kikuchi, Y., Yamashita, T. and Goda, Y. : Pharmaceutical and Medical Device Regulatory Science , 45 , 243- 250( 2014).
[5] Saito, T., Nakaie, S., Kinoshita, M., Ihara, T., Kinugasa, S., Nomura, A. and Maeda, T. : Metrologia , 41 , 213- 218( 2004).
[6] Yamazaki, T., Saito, T., Miura, T. and Ihara, T. : BUNSEKI KAGAKU , 61 , 963- 967( 2012).
欲了解更多相关产品请点击文字:定量NMR用标准溶液
