外泌体与生命现象——第六回 外泌体与病毒

东海大学综合医学研究所造血肿瘤领域 东海大学医学部血液·肿瘤内科 柿崎正敏、幸谷愛
◆前言
病毒感染有史以来就已经存在,但直到1898年口蹄疫病毒的发现,病毒才被定义为病原体。与人类疾病相关的病毒就有数百种,从日常生活中经常会遇到的呼吸道、消化道等急性感染病,到艾滋病、乙型肝炎和宫颈癌等慢性疾病都与各种病毒感染有关。近年来,有报道称,细胞外囊泡(Extracellular vesicles: EVs)中的外泌体与病毒的生存策略具有相关性。
本文将介绍病毒感染细胞释放出的外泌体与病毒性疾病的相关研究,然后进一步概述作者研究的B型肝炎病毒(Hepatitis B virus: HBV)感染细胞来源外泌体的功能。
◆外泌体的分泌
外泌体来源于向晚期内体中的多囊泡体(Multi vesicular body: MVB)出芽的腔内囊泡(intraluminal vesicles: ILVs),是约100 μm大小的囊泡1)。ILVs的形成与被称为ESCRT(endosomal sorting complex required for transport)的蛋白质复合物有关。MVB与细胞膜融合后,外泌体被分泌到细胞外。
◆病毒的出芽
病毒有几种出芽的途径,包括从细胞膜中直接出芽及通过MVB出芽等。有报道称,逆转录病毒、黄病毒、弹状病毒和副粘病毒等具有多层包膜的RNA病毒,可以通过ESCRT复合物和ESCRT相关蛋白的相互作用促进病毒从细胞膜中出芽2)。另外,HBV及E型肝炎病毒(Hepatitis E virus: HEV)也能与ESCRT复合物及ESCRT相关蛋白相互作用,然后通过MVB途径释放而出2,3)。综上,病毒会通过劫持ESCRT机制,来使自身顺利出芽。
◆病毒感染细胞来源外泌体的功能
除出芽之外,病毒还会劫持ESCRT机制向外泌体中输送病毒基因组和病毒相关蛋白,因此,外泌体有利于病毒的存活。实际上,HIV感染细胞来源的外泌体中,含有一种HIV病毒蛋白Nef,吸收了含有Nef的外泌体的细胞更容易感染HIV4,5)。另外,EBV阳性B细胞淋巴瘤来源的外泌体中含有EBV编码的miRNA,吸收了该外泌体的巨噬细胞会发生肿瘤相关的巨噬细胞样的特性改变,并且会促进肿瘤细胞的生长6)。
如上所述,迄今为止,有关各种病毒感染细胞来源的外泌体的功能分析一直在进行。下文将概述作者正在研究的HBV感染细胞来源的外泌体的功能。
◆HBV
HBV是世界范围内的传染病,全球估计有4亿持续性HBV感染患者,大部分集中在亚洲和非洲,而日本估计也有大约
100万HBV携带者。在日本,防止母婴传染的措施减少了新的感染,病毒复制逐渐能被核酸类似物控制,但仍未发现能完
全清除病毒的疗法。为了开发能完全消除HBV的治疗方法,首先需要明确B型肝炎变成慢性病的过程,然而,B型肝炎向
慢性病发展的过程中仍存在很多不清楚的部分。近年来,在慢性B型肝炎患者的血液中的单核细胞中,PD-L1的表达增
加7),尤其是HBV特异性CD8阳性T细胞中的PD-L1的表达,细胞毒性显著下降8)。 因此,PD-1/PD-L1-axis有可能是慢性B型肝炎致病原因之一。对此,作者假设含有HBV感染细胞释放出的外泌体的EVs参与了B型肝炎发展成慢性B型肝炎的过程,并对此进行了研究。
◆HBV感染细胞来源EVs的功能
除外泌体外,HBV感染细胞还会释放大量仅含有HBs抗原的非感染性中空颗粒。这些中空颗粒具有HBs抗体诱饵的作用,但实际功能仍未明确。本文记述了含有外泌体、中空颗粒和HBV病毒颗粒的EVs。为了找出HBV感染细胞来源的EVs被何种细胞吸收,作者先向人末梢血单核细胞(Peripheral blood mononuclear cells:PBMCs)的培养上清中投放荧光标记的HBV感染细胞来源的EVs,24小时后再用FACS进行分析。结果,单核细胞会选择性地吸收EVs(图1A)。在吸收了EVs的单核细胞中,PD-L1的表达增加(图1A),免疫细胞的活性标记物CD69的表达减少。接下来,为了鉴定与PD-L1 和CD69表达增减相关的颗粒,作者利用密度梯度离心法分离外泌体、中空颗粒和HBV病毒颗粒,然后将各种颗粒分别投放到PBMC培养上清中,24小时后确认PD-L1的表达。结果发现,所有颗粒中的PD-L1表达增加,CD69表达减少,特别是外泌体和中空颗粒会使PD-L1表达增加(图1B),CD69表达减少。据以上所述,HBV感染细胞来源的外泌体与中空颗粒可能对吸收的单核细胞具有免疫抑制能力9)。
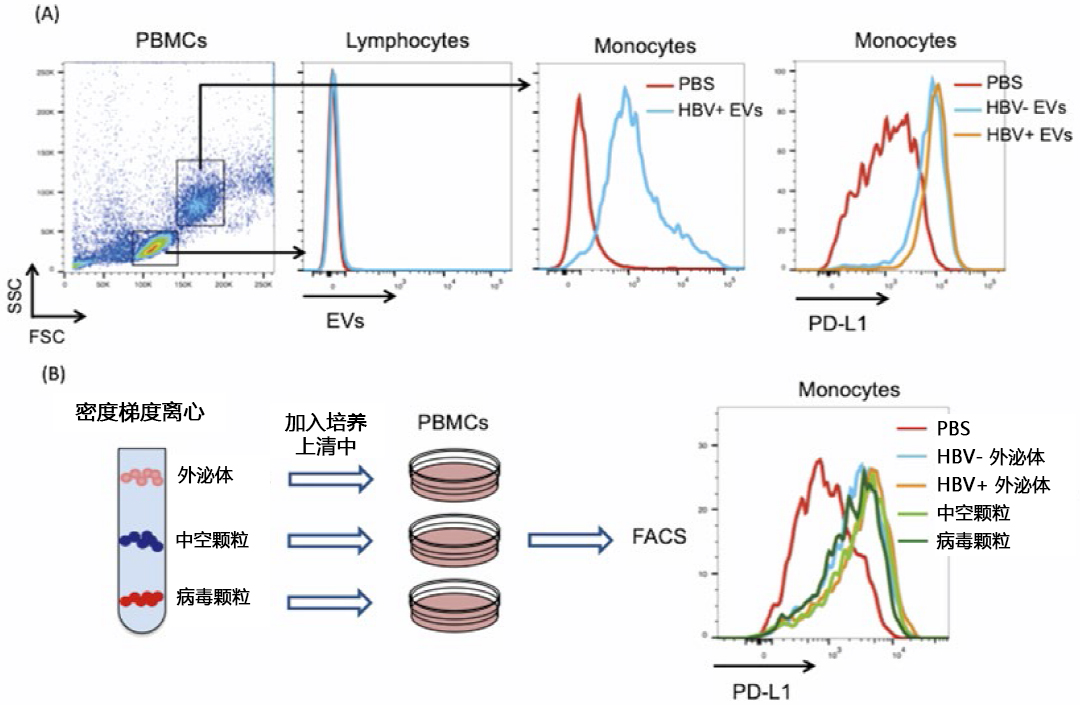
图1
其次,为了调查HBV感染细胞来源EVs是否也会在体内诱导免疫抑制,作者使用HBV感染的小鼠模型进行了研究。为了在小鼠体内获得肝炎实验体系,在用HBs抗原免疫了三次的小鼠中,使用Hydrodynamic injection(HDI)法将野生型HBV复制子质粒转染到肝脏中。由此能获得HBV肝炎模型。进行HDI的2小时后,从尾静脉处注射HBV感染细胞来源的EVs,3天后再检查肝脏中的细胞浸润和HBc抗原表达。结果发现,在未注射HBV感染细胞来源的EVs的小鼠肝脏中能观察到大量的细胞浸润,而且几乎无法确认HBc 抗原(图2)。另一方面,注射了HBV感染细胞来源EVs的小鼠肝脏几乎没有细胞浸润,并且能观察到许多HBc抗原(图2)。上述结果表明,HBV感染细胞来源EVs会诱导体内免疫抑制。

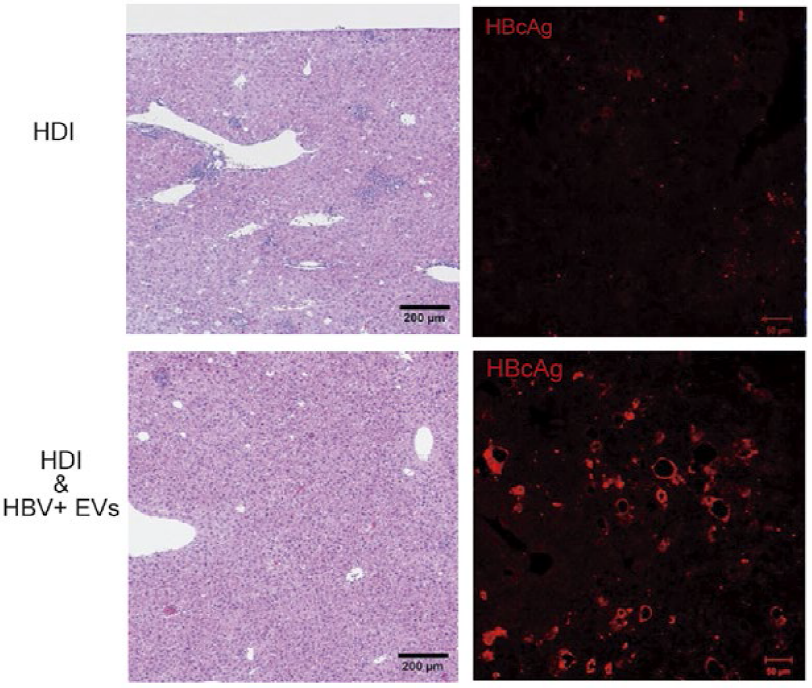
图2
◆结语
在外泌体发现初期,其被认为是细胞释放出无用的蛋白质和核酸的机制。但如今,外泌体作为细胞间通信器,和各种疾病的诊断和治疗的目标而受到关注。在本文中,作者介绍了一些与病毒感染细胞来源外泌体功能相关的研究,研究表明外泌体参与了所有生命现象。许多研究都阐明了外泌体的生物学意义,但是关于其作用机制和产生过程的细节仍有许多不明确的部分。期待作者的研究能有助于未来的外泌体研究。
〔参考文献〕
1) Murk, J. L. et al . : Semin. Cell Dev. Biol ., 13(4), 303( 2002).
2) Selzer, L. and Zlotnick, A. : Cold SpringHarb. Perspect. Med ., 5( 12), 0021394( 2015).
3) Nagashima, S. et al . : J. Gen. Virol ., 95, 2166(2014).
4) Campbell, T. D. et al . : Ethn. Dis ., 18( 2 Suppl 2), S2-14( 2008).
5) Arenaccio, C. et al . : J. Virol ., 88, 11529( 2014).
6) Higuchi, H. et al . : Blood , 131 (23), 2552(2018).
7) Huang, Z. Y. et al . : Viral Immunol ., 30 (3),224( 2017).
8) Boni, C. et al . : J. Virol ., 81, 4215( 2007).
9) Kakizaki, M. et al . : PLoS One , 13 (12),e0205886( 2018).
◆外泌体相关试剂盒
| 产品编号 |
产品名称 |
规格 |
包装 |
| 299-77603 |
MagCapture™ Exosome Isolation Kit PS
MagCapture™外泌体提取试剂盒PS |
基因研究用 |
2 tests |
| 293-77601 |
10 tests |
| 298-80601 |
PS Capture™ Exosome ELISA Kit (Streptavidin HRP)
PS Capture™外泌体ELISA试剂盒(链霉亲和素HRP) |
基因研究用 |
96 tests |