外泌体和生命现象——第二回 外泌体蛋白质组解析
![]()
公益基金会癌症研究小组 植田 幸嗣
外泌体是一种微分泌囊泡。它是细胞内囊泡转运的产物之一,具有将不需要的分子释放出细胞外、并将内含分子运输和传递到远端细胞的功能。通常,外泌体具有直径为几十至一百纳米的脂质双分子层结构,与细胞结构成分相比,特定蛋白质组(四次跨膜蛋白超家族,Rab家族,Tsg101,Alix等)和miRNA的含量特别多。然而,有研究结果指出,通过细分粒径进行组学分析时,发现特定粒径的分子结构明显不同1),所以如今外泌体的分子生物学定义仍未明确。事实上,有不少报道认为通过使用各种不同的外泌体提取方法(使用提取纯度不同的外泌体样本)进行的功能分析实验发现,外泌体参与癌症转移、肿瘤浸润、血管新生、免疫细胞调节等现象。
另一方面, "从释放到外周血等体液中的、来自致病细胞的外泌体中,可以读取致病细胞的分子谱"这一点已被证实了。以诊断为目的外泌体应用已经商业化。例如,在CLIA(Clinical Laboratory Improvement Amendments)认证的实验室开发的,通过尿液中的外泌体同时检测前列腺癌特异性PCA3非编码RNA,ERG mRNA,SPDEF mRNA的测试(ExoDx® Prostate IntelliScore),并且可以作为LDT(Laboratory Developed Tests:实验室内部研发、验证、使用的体外诊断测试)进行国际委托技术服务2)。此外,Wako还建立了一项从血浆中一步分离外泌体DNA/RNA及cfDNA(circulating free DNA)的技术,并发表了一项从血液样本中检测非小细胞肺癌EGFR-T790M突变的检测方法(ExoDx® EGFRT 790 M)。该突变导致60%接受EGFR抑制剂治疗的肺癌患者产生耐药性。有这种EGFR突变,就应及时替换Osimertinib等有效药物进行治疗,故快速的耐药诊断非常重要。通过对210例EGFR突变肺癌患者的对比试验,目前认可的cfDNA诊断法(cobas® EGFR Mutation Test v2)检测T790M的灵敏度是58%,特异性是80%;而ExoDx® EGFR T790M 检测的灵敏度是92%,特异性是89%。相比之下,ExoDx® EGFR T790M 检测可获得更好的诊断结
果3)。
在此背景下,无论是基础生物学研究还是临床应用,都需要实验室之间能够零差异再现的高纯度外泌体,一种任何人能轻松分离和纯化外泌体的工具是不可或缺的。特别是,如果研究对象是从血清和血浆样本中提取纯化的外泌体蛋白,则需要非常高的纯化水平。血清·血浆的蛋白浓度超过60mg/mL,还存在许多高分子量复合物如脂蛋白,即使是外泌体提取常用的超速离心沉淀法,仍然会存在大量血清游离蛋白(IgM,α2 -巨球蛋白,补体成分等)和脂蛋白。因此,通过LC/MS对超速离心法提取的血清蛋白进行全面定量蛋白质组分析时,几乎所有含量都是血清游离蛋白,只检测出了微量的外泌体蛋白。4)
除超速离心法外,外泌体的提取方法还有抗体亲和法、聚合物沉淀法、凝胶过滤法以及从切除的组织浸液中直接回收的方法5) 等。MagCapture™ Exosome Isolation Kit PS(下文称为MagCapture试剂盒)的原理是亲和纯化磷酯酰丝氨酸PS (磷酯酰丝氨酸是构成外泌体膜的脂质之一)。与其它方法相比具有各种各样的优点。固定在磁珠上的Tim-4蛋白与PS在钙离子存在的条件下结合,通过螯合剂洗脱,可以不洗脱非特异性磁珠结合蛋白而特异性洗脱外泌体,因此提取的纯度很高。另外,只要磁珠纯化操作可以顺利进行,就不受样本容量的限制,即使是用稀释的样本也同样有效。此外,由于在没有变性溶解的情况下进行洗脱,后续的粒子计数检测、显微镜检查和细胞给药实验等应用均可放心使用。
根据图1A的方法,从相同血清中提取外泌体,并通过Orbitrap Fusion Lumos质谱仪进行综合蛋白质组分析。结果显示,超速离心提取外泌体的总蛋白质鉴定数为612种,MagCapture试剂盒提取外泌体的总蛋白质鉴定数为1,103种,后者是前者的约1.8倍(图1B)。这是因为超速离心法的血清中残留大量的游离蛋白质,掩盖了微量外泌体来源的信号。此外,比较鉴定的蛋白质以及相对定量值,可以看出,MagCapture试剂盒提取的外泌体中,被认为是外泌体标记蛋白的恒定分子组合以及相对含量都要更多(图2)。由此可见,通过试剂盒提取的外泌体纯度远高于现有的超速离心沉淀法。
使用高纯度的外泌体,有利于阐明外泌体的功能以及探索诊断和治疗药物,使研究结果更具可信度。从外泌体提取的纯度、灵活性、可重复性等方面来看,MagCapture试剂盒适合作为所有外泌体研究的起点。但是,通过该试剂盒回收的产物也是一组含有大量PS膜组分的无限定尺寸的集合,是否等同于其他现有研究指出的外泌体,还需要后期的组学分析来进行仔细评估和定义。随着包括MagCapture试剂盒在内的提取纯化技术以及检测技术的发展,我们期待对外泌体的本质阐明和临床应用的进一步发展。
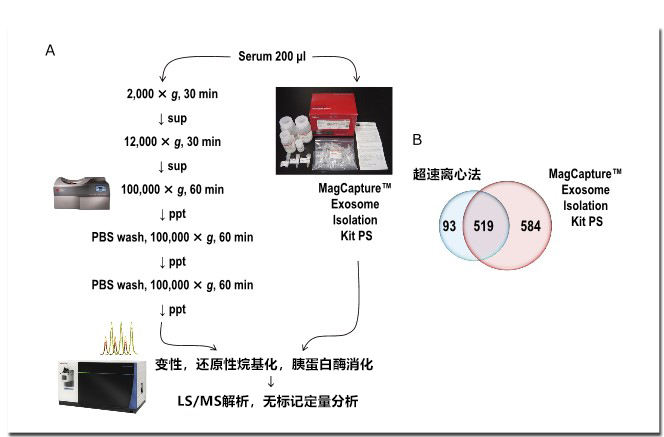
图1. 提取纯度对外泌体蛋白质组分析的影响
A)通过超速离心沉淀法和MagCapture™ Exosome Isolation Kit PS提取血清中的外泌体并进行质谱分析
B)鉴定出的蛋白数量和重叠部分
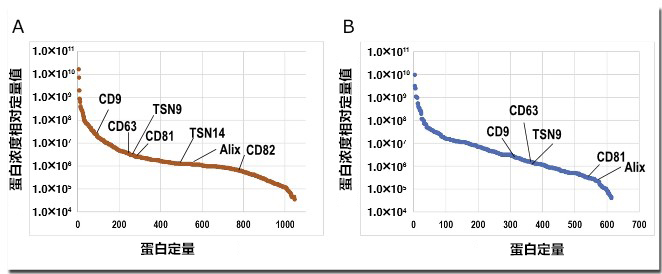
图2. 鉴定外泌体蛋白质的定量顶视图
A) MagCapture™ Exosome Isolation Kit PS及B)超速离心沉淀法提取血清中外泌体的蛋白质组定量分析结果
B)收集并记录了有报道作为外泌体标记物的蛋白。
◆参考文献
|
[1] |
Zhang, H. et al. :"Identification of distinct nanoparticles and subsets of extracellular vesicles by asymmetric flow field-flow fractionation", Nat. Cell Biol., 20, 332(2018). |
|
[2] |
McKiernan, J. et al . :"A Novel Urine Exosome Gene Expression Assay to Predict High-grade Prostate Cancer at Initial Biopsy", JAMA. Oncol., 2, 882(2016). |
|
[3] |
Castellanos-Rizaldos, E. et al . :"Exosomebased Detection of EGFR T790M in Plasma from Non-Small Cell Lung Cancer Patients", Clin. Cancer Res ., DOI : 10.1158/1078-0432. CCR-17-3369(2018). |
|
[4] |
植田幸嗣:「プロテオーム解析から見たバイ オマーカーとしてのエクソソームとその特 徴」, 細胞工学, 32, 71(2013). |
|
[5] |
Jingushi, K. et al. :"Extracellular vesicles isolated from human renal cell carcinoma tissues disrupt vascular endothelial cell morphology via azurocidin", Int. J. Cancer , 142, 607(2018). |
◆产品列表
MagCapture™ 外泌体提取试剂盒PS
|
产品编号 |
产品名称 |
规格 |
容量 |
|
299-77603 |
MagCapture™ 外泌体提取试剂盒PS |
基因研究用 |
2次 |
|
293-77601 |
10次 |