生物制药残留DNA提取试剂盒(碘化钠法)
- 产品特性
- 相关资料
- Q&A
- 参考文献
生物制药残留DNA提取试剂盒(碘化钠法)![]()
残留DNA提取试剂盒遵照中国药典记载的碘化钠法,适用于疫苗和治疗用生物制品所含宿主细胞残余DNA的提取。
残留DNA提取试剂盒可以提取样品中含有的极微量的DNA,回收率较高。DNA的提取操作时间为60-90 min。提取的DNA可以通过qPCR进行定量。
|
|
|
◆特点
● 高回收率回收微量DNA(100-1,000 fg)
● 无需更换试管(全程仅使用1根试管)
● 整个提取过程仅需60-90 min
● 提供高浓度蛋白样品的前处理实验方案
● 回收后的DNA可通过qPCR、Threshold Assay(Molecular Devices)进行定量
● 采用碘化钠法
◆原理
1. 使样品中的蛋白质和脂质溶于碘化钠和月桂酰肌氨酸钠;
2. 异丙醇与糖原选择性地共沉淀DNA。
◆标准步骤
◆应用实例
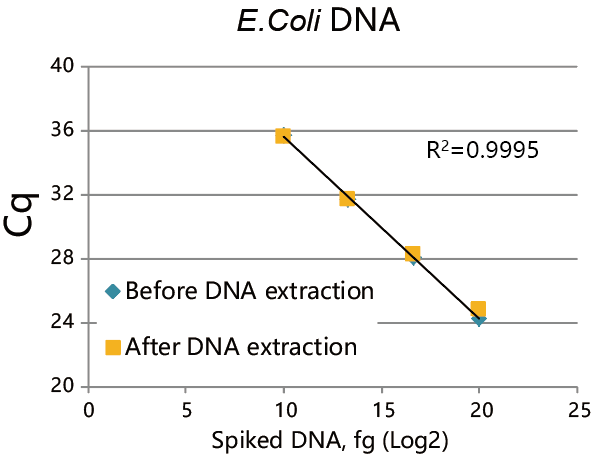
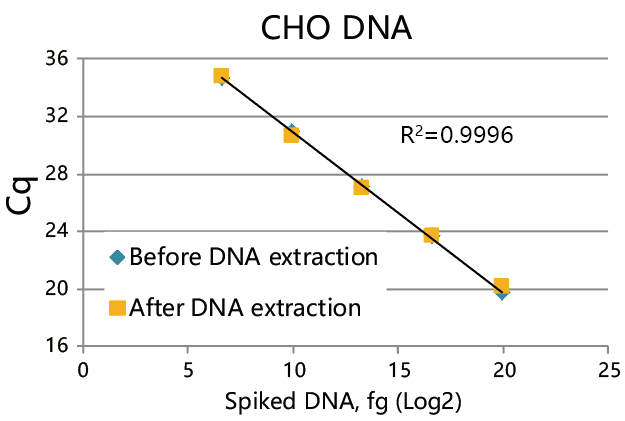
DNA spiking test(加标回收实验)
|
|
|
|
|
DNA Extractor™ Kit可以高产量提取残留DNA,甚至少量残留DNA。
◆抗体药物适用性研究
从高蛋白溶液中提取DNA
使用不同浓度的IgG溶液检测CHO来源DNA的加标回收率。
方法
1) 向不同浓度的IgG溶液(10-100 mg/mL)中添加2 pg/mL CHO来源DNA。
2) 按照本产品说明书记载的实验方案提取DNA。
● 提取实验方案:Protocol#2
● 样品前处理:蛋白浓度超过2 mg/mL时实施的前处理方案(Proteinase K处理)
3) 通过qPCR法计算提取的CHO来源DNA的回收率。
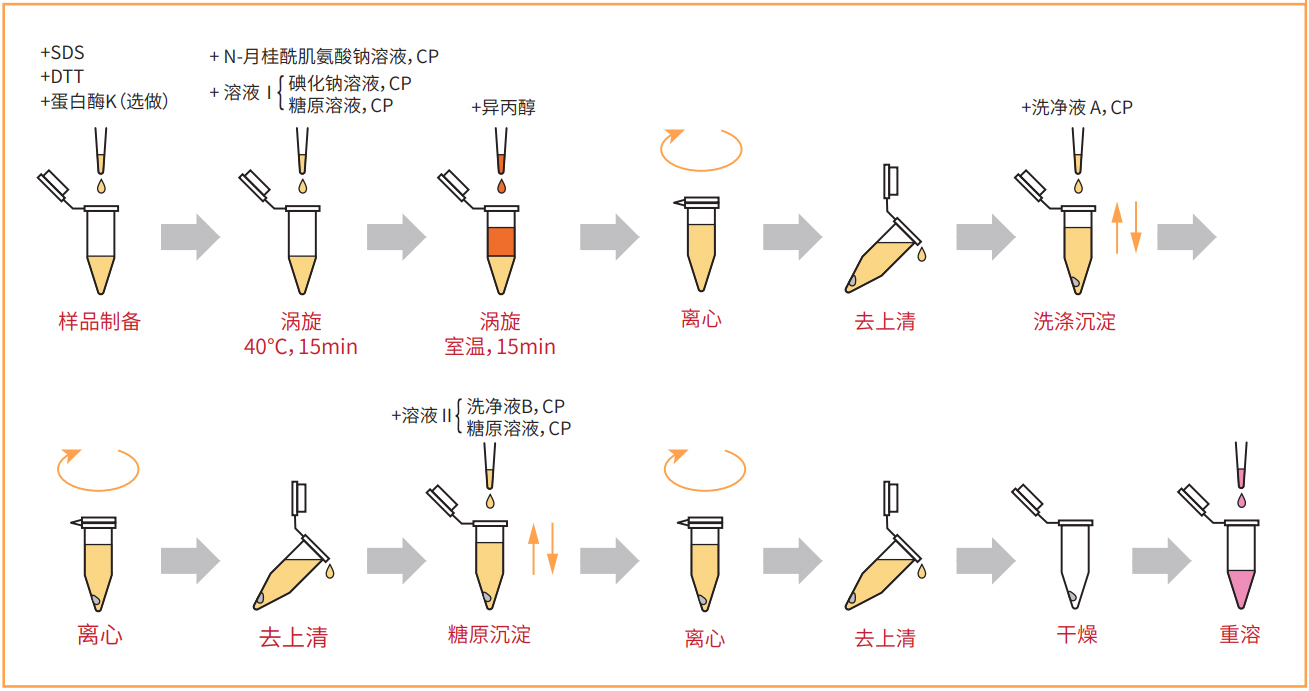
结果
不同蛋白浓度溶液的Cq值
|
Sample |
Input |
蛋白浓度 (mg/mL) |
|||||
|
10 |
20 |
40 |
60 |
80 |
100 |
||
|
Cq |
31.596 |
31.566 |
31.351 |
31.726 |
31.502 |
31.282 |
31.658 |
|
31.599 |
31.608 |
31.774 |
31.787 |
- |
31.485 |
31.66 |
|
|
31.338 |
31.861 |
31.5 |
31.85 |
31.56 |
31.369 |
- |
|
|
Average Cq |
31.511 |
31.678 |
31.542 |
31.788 |
31.531 |
31.379 |
31.659 |
|
Difference of Cq |
0 |
-0.167 |
0.136 |
-0.246 |
0.257 |
0.152 |
-0.28 |
|
Power |
1 |
0.891 |
1.099 |
0.843 |
1.195 |
1.111 |
0.824 |
|
Recovery Rate (%) |
100 |
89.1 |
109.9 |
84.3 |
119.5 |
111.1 |
82.4 |
不同蛋白浓度溶液的CHO来源DNA回收率
结果显示,即使蛋白浓度高达100 mg/mL,也能高回收率提取CHO来源DNA。
从抗体药物模拟溶液中提取 DNA
检测抗体药物常用的Buffer及添加剂制备的IgG溶液中的 CHO来源DNA的加标回收率。
方法
1) 向抗体药物中常用的Buffer组成(表1.①-⑥)及添加剂溶液中添加20 mg/mL的IgG蛋白,制备不同的抗体药物模拟溶液。向不同溶液中添加
1) 20 pg/mL CHO来源DNA。
2) 根据本产品说明书记载的实验方案提取DNA。
● 提取实验方案:Protocol#2
● 样品前处理:蛋白浓度超过2 mg/mL时实施的前处理方案(Proteinase K处理)
3) 通过qPCR法计算提取的CHO来源DNA的回收率。
表1 Buffer组成
|
No. |
Buffer组成 |
|
① |
10 mM PB pH 6.0, 0.15 M NaCl, 2 mM EDTA |
|
② |
10 mM PB pH 7.4, 0.15 M NaCl, 2 mM EDTA |
|
③ |
50 mM NaOAc pH 5.2, 0.15 M NaCl, 2 mM EDTA |
|
④ |
10 mM PB pH 6.0, 2 mM EDTA |
|
⑤ |
10 mM PB pH 7.4, 2 mM EDTA |
|
⑥ |
50 mM NaOAc pH 5.2, 2 mM EDTA |
表2 添加剂溶液
Buffer: 10 mM PB pH 6.0, 0.15 M NaCl, 2 mM EDTA
|
No. |
添加剂(浓度) |
|
① |
Sucrose (10 w/v%) |
|
② |
Trehalose Dihydrate (10 w/v%) |
|
③ |
D(-)-Mannitol (10 w/v%) |
|
④ |
D(-)-Sorbitol (10 w/v%) |
|
⑤ |
D(+)-Maltose Monohydrate (10 w/v%) |
|
⑥ |
L(+)-Arginine Hydrochloride (1 w/v%) |
|
⑦ |
L‐Histidine (1 w/v%) |
|
⑧ |
Glycine (1 w/v%) |
|
⑨ |
Polyoxyethylene(20) Sorbitan Monooleate (Tween80) (0.5 v/v%) |
|
⑩ |
Polyoxyethylene(20) Sorbitan Monolaurate (Tween20) (0.5 v/v%) |
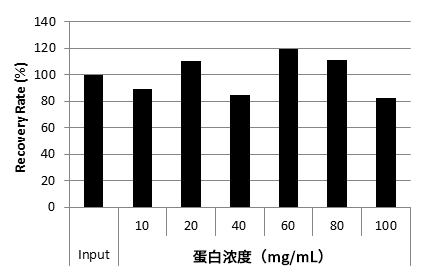
结果
不同Buffer的Cq值
| Sample | Input | Buffer | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | ||
| Cq | 31.473 | 31.693 | 31.544 | 31.218 | 31.058 | 31.595 | 31.181 |
| 31.364 | 31.196 | 30.973 | 31.568 | 31.085 | 31.343 | 31.112 | |
| 31.045 | 31.53 | 31.787 | 31.315 | 30.942 | 31.452 | 31.558 | |
| Average Cq | 31.294 | 31.473 | 31.435 | 31.367 | 31.028 | 31.463 | 31.284 |
| Difference of Cq | 0 | -0.179 | -0.141 | -0.073 | 0.266 | -0.169 | 0.01 |
| Power | 1 | 0.883 | 0.907 | 0.951 | 1.203 | 0.89 | 1.007 |
| Recovery Rate (%) | 100 | 88.3 | 90.7 | 95.1 | 120.3 | 89 | 100.7 |
不同Buffer的CHO来源DNA回收率
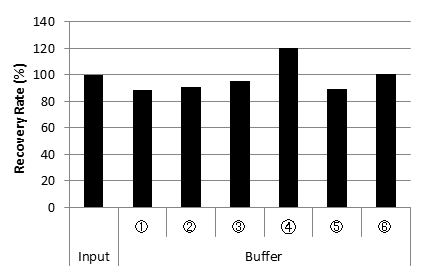
不同添加剂溶液的Cq值
|
Sample |
Input |
添加剂溶液 |
|||||||||
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
||
|
Cq |
31.473 |
31.826 |
31.327 |
30.907 |
31.143 |
31.071 |
31.525 |
- |
31.525 |
31.013 |
31.086 |
|
31.364 |
31.194 |
30.991 |
31.759 |
31.103 |
31.279 |
31.068 |
31.442 |
31.203 |
31.34 |
30.87 |
|
|
31.045 |
30.703 |
- |
31.009 |
- |
30.978 |
31.225 |
31.479 |
30.757 |
31.02 |
31.02 |
|
|
Average Cq |
31.294 |
31.241 |
31.159 |
31.225 |
31.123 |
31.109 |
31.273 |
31.461 |
31.162 |
31.124 |
30.992 |
|
Difference of Cq |
0 |
0.053 |
0.135 |
0.069 |
0.171 |
0.185 |
0.021 |
-0.167 |
0.132 |
0.17 |
0.302 |
|
Power |
1 |
1.037 |
1.098 |
1.049 |
1.126 |
1.137 |
1.015 |
0.891 |
1.096 |
1.125 |
1.233 |
|
Recovery Rate (%) |
100 |
103.7 |
109.8 |
104.9 |
112.6 |
113.7 |
101.5 |
89.1 |
109.6 |
112.5 |
123.3 |
不同添加物溶液的CHO来源DNA回收率
结果显示,即使含有不同Buffer组成和添加剂的IgG溶液也能高回收率提取CHO来源DNA。
◆试剂盒构成
|
产品编号 |
内容物 |
内容量 |
|
299-81111 |
碘化钠溶液, CP |
26 mL |
|
296-81121 |
月桂酰肌氨酸钠, CP |
1.2 mL |
|
293-81131 |
洗净液A, CP |
42 mL |
|
290-81141 |
洗净液B, CP |
40 mL×2 |
|
297-81151 |
糖原溶液, CP |
0.1 mL |
备注:每种成分不单独出售
※ 本页面产品仅供研究用,研究以外不可使用。
查看更多相关产品:残留DNA提取&检测系列
点击链接查看DNA Extractor Kit——2020中国药典版碘化钠法操作步骤图文版
相关资料

残留DNA检测试剂盒套装
|
[1] |
Ikeda, Y., Iwakiri, S., & Yoshimori, T. (2009). Development and characterization of a novel host cell DNA assay using ultra-sensitive fluorescent nucleic acid stain "PicoGreen". Journal of pharmaceutical and biomedical analysis, 49(4), 997-1002 |
|
[2] |
Cai, H., Gu, X., Scanlan, M. S., & Lively, C. R. (2011). Development of a quantitative PCR assay for residual mouse DNA and comparison of four sample purification methods for DNA isolation. Journal of pharmaceutical and biomedical analysis, 55(1), 71-77. |
|
[3] |
牛冬云, 连炜, 何静, 邬智刚, & 柯潇. (2013). 康柏西普制品中 CHO 细胞 DNA 残留量的检测. 中国生物制品学杂志, 26(7), 1023. |
|
[4] |
周朝东, 黄哲, & 尉然. (2016). 荧光定量pcr法测定重组人干扰素α2b原液中宿主dna的残留%determination of residual host cell dna in recombinant human interferonα2 b substances by quantitative pcr. 中国生化药物杂志, 036(004), 193-195. |
|
[5] |
周朝东, 苏喆, & 黄哲甦. (2017). 荧光定量pcr法测定重组人/门冬胰岛素原料中宿主dna的残留量%determination of residual host cell dna in recombinant human/aspart insulin substances by quantitative pcr. 药物分析杂志, 037(003), 477-481. |
|
[6] |
任玉莹, 刘建凯, 尹珊珊, 徐颖之, 邓海清, & 殷建齐等. (2017). Sabin株脊髓灰质炎灭活疫苗宿主细胞dna残留量检测方法研究. 国际生物制品学杂志(40), 124. |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 292-81101 | 残留DNA提取试剂盒(碘化钠法) DNA Extractor™ Kit for Residual DNA, CP Method (Sodium Iodide Method) |
50 tests | – | – |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 290-85301 | QCdetect(TM) Residual DNA Detection Kit for E. coli QCdetect™ 残留DNA检测试剂盒,大肠杆菌用 |
100 tests | – | – |
| 294-85201 | QCdetect(TM) Residual DNA Detection Kit for CHO cells QCdetect™ 残留DNA检测试剂盒,CHO细胞用 |
100 tests | – | – |