第一回 透明化技术Scale 的介绍和应用

国立研究开发法人理化学研究所 脑神经科学研究中心 细胞功能探索技术研究小组
濱裕教授、星田哲志教授以及宮脇敦史教授共同执笔
◆前言
固定组织的透明化技术将过去以二维为主体进行研究的组织学大幅扩展到三维层面上,使其获得全新视野。近年来,透明化技术不仅被应用于动物而且被应用到了植物的研究中,并且从基础生物学领域到其他医学领域方面,这项技术的应用范围也在逐渐扩大。
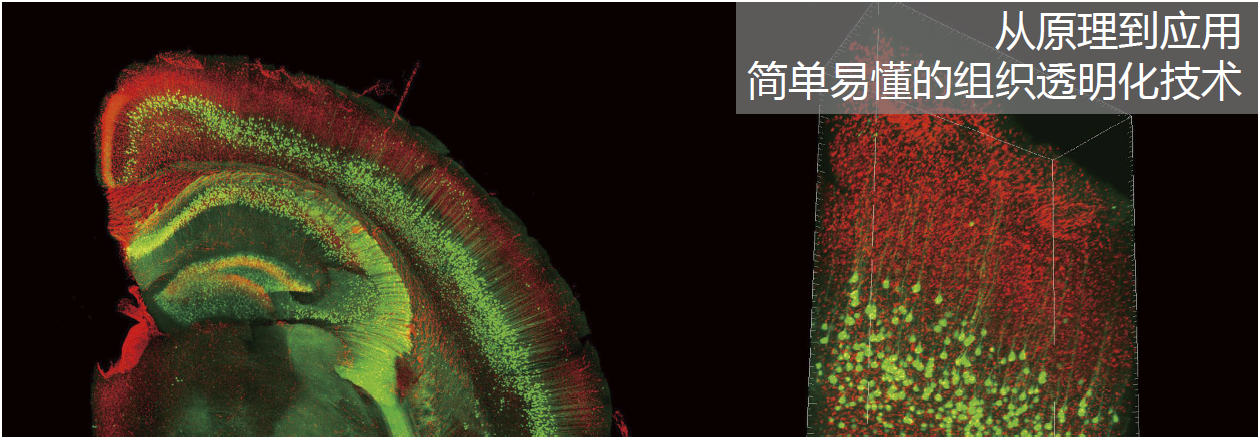
ScaleA2法[1] 和ScaleS法[2](以下统称Scale法)都是作者团队开发的透明化技术。此外,作者团队还开发了AbScale法,这是一种与透明化技术相匹配的三维免疫染色法。上述两种方法配合使用可以获取小鼠全脑、大脑半球或厚脑切片内的精细结构。图1为实验图像。
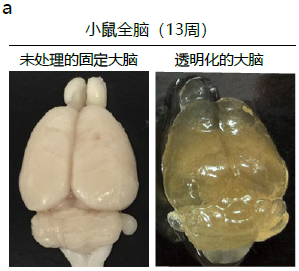
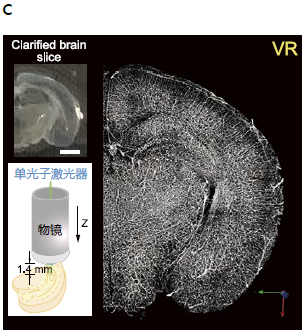
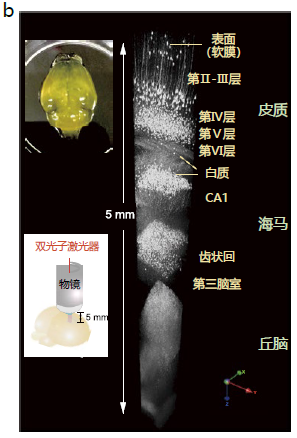
图1. 利用ScaleS法的透明化实验以及AbScale法的染色案例
a. 未处理的小鼠全脑(左)和透明化的小鼠全脑(右)。两者都取自固定的C57BL6/J雄性小鼠(13周)。
b.从大脑表面到丘脑,用双光子激光器(直立型)显微镜观察(左下)透明化的YFP-H小鼠(14周,雄性)全脑(左上),再重建三维图像(VR)(右)。
c. 使用Tomato lectin-texas red对已透明化处理的新生小鼠(C57BL6/J,出生后10.5天)大脑的冠状切片(1.2 mm厚)(左上)进行血管染色,利用直立共聚焦激光扫描显微镜(CLSM)观察(左下)到的VR图像(右)。
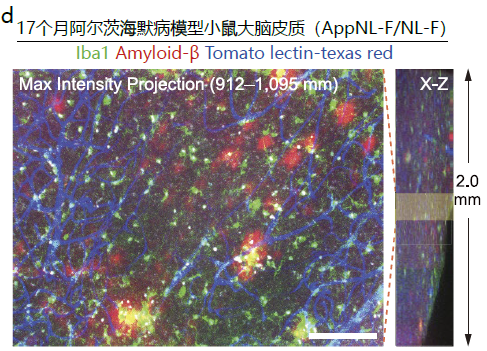
d. 此图是对阿尔茨海默病模型小鼠((AppNL-F/NL-F,17个月,雄性)大脑的冠状切片进行Tomato lectin-texas red血管染色(图中蓝色部分),再用AbScale法免疫染色切片,并通过透明化后观察到的图像。染色时使用了红色荧光色素635结合Iba1多克隆抗体(FUJIFILM Wako 产品编号:013-26471,图中红色部分)和Alexa Fluor 488结合amyloid-β单抗(图中绿色部分)。用直立型CLSM观察皮质部分。左边是叠加10个浅黄色长方形区域的X-Y平面(Z-step =7 μm,对应右边的浅黄色长方形区域)获得的图像(max intensity projection)。右边表示2 mm高的角柱状观察区域的X-Z平面。比例尺分别为5 mm(a、b、c)和100 μm(d)
Scale法用到的试剂溶液都购自FUJIFILM Wako的SCALEVIEW系列试剂。作者将在下文中对透明化过程中用到的Scale试剂标记上对应的SCALEVIEW试剂名称。上述的ScaleA2法和ScaleS法分别使用了SCALEVIEW-A2及SCALEVIEW-S系列的试剂。使用这两种试剂进行透明化实验和三维染色的步骤请浏览FUJIFILM Wako官网,上面有相关内容的详细介绍。
本文围绕透明化技术的现状与基础,重点阐述Scale法。另外,还会像实验说明书一样,介绍显微镜观察透明化组织时的要点。
◆透明化技术的现状
透明化技术主要应用于神经科学领域。特别是在观察导入了荧光蛋白基因的神经细胞时,透明化技术能发挥巨大的作用。用导入了荧光蛋白基因的病毒(例如腺相关病毒(AAV))来感染大脑的特定区域,能标记特定的神经细胞。通过组织固定和透明化,利用显微镜可以观察目标神经细胞的轴突延伸程度。Economo[3] 和Ye研究团队[4] 在神经回路透明化分析方面表现出了浓厚的兴趣。
在过去的10年里,世界各国的研究人员开发并提出了多种透明化技术。所有这些透明化技术都有研究人员各自的特色。可以参考Tainaka(2016)[5] 和日置研究团队(2017)[6] 的技术文章,里面简单、系统地总结了这些特点。
最近备受关注的透明化技术应用是生物发光成像(BLI)技术与透明化技术的结合。首先,用病毒载体使荧光素酶基因和荧光蛋白基因在同一神经细胞中共表达,以生物发光信号进行非侵入性的实时检测。接下来通过观察检测固定好的透明化大脑中荧光蛋白信号,由此可以确认该神经活动来源于哪种细胞。尤其是本作者研究室开发的AkaBLI系统,灵敏度极高,即使体内只有一个标记细胞,也能追踪到它的信号[7]。BLI技术与透明化技术相结合的应用不仅限于神经科学领域,还能应用于癌症、免疫及干细胞的研究领域。
除了上述以in vivo为中心的研究外,透明化技术还有另一个值得关注的领域。就是在体外(in vitro)使用模拟球状体和类器官等组织的三维细胞培养研究。近年来,这些细胞团经常被用于药物筛选等实用性研究。应用透明化技术,能详细观察这种细胞团。在本文的最后,作者将举出一个神经球状体(Nsp)的例子来解释Scale法的应用。
◆Scale法进行透明化的基本原理
众所周知,大部分活组织都是混浊不透明的。这是由于组织的组成成分使光线发生散射而造成的。混浊的组织会对显微镜观察带来极大的不便。组成细胞膜的脂质、细胞外基质和结缔组织(如胶原纤维等)等物质都是造成光线散射的主要原因。为了尽量减少这种生物组织造成的光散射,大部分透明化技术都致力于用高浓度表面活性剂和有机溶剂主动去除组织中的脂质成分。
与上述方法不同, Scale法使用了以尿素为主要成分的试剂溶液。尿素是一种具有保水性的蛋白质变性剂。笔者利用尿素的这种性质来使组织亲水化(hydration),以达到减少光线散射的目的。换句话说,尿素在软化组成结缔组织纤维的同时还可使其注入水分,还能将水分运入细胞质膜的脂质分子之间,这就是Scale法进行透明化的基本原理。
作者在ScaleA2法之后又开发了ScaleS法(使用SCALEVIEW-S系列试剂的方法),使用的试剂溶液中除了尿素,还有一种叫做山梨糖醇的糖醇。山梨糖醇和尿素一样,都是具有高保水能力的物质。其协同尿素将水分配位到组织中,可以进一步减少组织的光散射。
用于ScaleS法的溶液含有低浓度的TritonX-100 [0.1-0.2 %(w/v)浓度]。在该浓度范围内,TritonX-100的脂质提取效果非常温和,对细胞膜的损伤也相对较小。用PBS(-)对已用ScaleS法透明化处理过的小鼠脑组织进行脱透明化,通过透射电子显微镜观察由同一组织制成的超薄切片来进行进一步的验证。结果显示,神经细胞质膜及兴奋性突触周围的超细微膜结构状态良好,确认了ScaleS法的作用温和[2] 。
◆观察Scale法透明化样品时的要点
“透明化组织的图像模糊不清”、“图像太暗”等都是观察透明化组织时会遇到的问题,可能使观察无法顺利进行。主要原因是研究人员对浸入样品的浸液(固定液)的折射率和物镜的相关信息了解得不够全面。
为了用共聚焦激光扫描显微镜或双光子激发荧光显微镜更好地观察有厚度的透明化组织的内部,我们需要特别注意物镜和组织、组织和固定溶液之间折射率的匹配。只要物镜和组织、组织和固定溶液之间的折射率存在差异(不匹配),组织内的焦点就会变得分散,在组织深层的方向(Z方向)上延伸形成模糊不清的图像,或者内部的图像过暗。
近年陆续开发出的透明化技术都倾向于使用SCALEVIEW-S试剂之类的高折射率(1.43~1.56)固定溶液。在Scale法中,固定溶液SCALEVIEW-S4(折射率1.47)或者能获得更高透明度的SCALEVIEW-SMt(折射率1.49)都能充分平衡透明化的组织。
也就是说,我们要注意固定溶液和物镜之间的折射率。观察的物镜最好要符合溶液的折射率。如果没有能匹配高折射率固定溶液的物镜,可尝试用SCALEVIEW-S4等试剂进行透明化后,再用SCALEVIEW-A2(折射率1.38)替代固定溶液,在37 ℃下平衡数小时,就能通过水浸物镜对组织1~2 mm的深度进行观察。但需要注意,用SCALEVIEW-A2替代SCALEVIEW-S4时,组织会轻微膨胀。详细信息将发布在Protocol Exchange中 [8]。
为了防止观察出现问题,必须提前收集要用到的固定溶液的特点和折射率等相关信息,了解物镜是否适用,以及镜片的工作距离,这些信息最好在进行观察前确认好。如果信息不明确,应联系各试剂和显微镜厂商,咨询观察样品适用的方法。以上内容对Scale法及其他透明化技术都通用。
◆Scale法在神经球中的应用
显微镜很难观察到固定的多细胞球状体的内部。多细胞球状体已形成细胞外基质,且细胞之间紧密堆积,导致中心部分的浊度特别高。为了观察细胞块的内部,过去通常需要用物理性切割制作出数十微米厚的切片,而透明化技术能有效解决制作小细胞块切片带来的麻烦和难度。FUJIFILM Wako官网介绍了染色、透明化成人海马来源的神经干细胞制备的神经细胞球状体(Nsp)的AbScale法的操作流程。本文将为大家介绍一种在该操作流程的基础上进行过优化的方法。
用4 %PFA/PBS(-)固定Nsp后,再使用SCALEVIEW试剂按照S0→A2→8M urea solution (要求是自制的) →A2的顺序进行前处理。除前处理外,后续所有液体的交换都要温和离心(500×g,15分钟,常温)Nsp的悬浮液,然后尽量吸出上清,再加入下一步的溶液。前处理的过程中,利用Nsp的膨胀可以提高细胞间的细胞外基质的柔软性。该过程不仅有助于对Nsp内抗体的渗透,还能促进染色后的Nsp的透明化。
接下来,透明化的Nsp在deScale中再次被还原。此过程具有为后续的免疫染色重新激活抗原性以及将膨胀的组织恢复到原来大小的双重意义。
在deScale之后进行封闭,然后通过使用荧光标记一抗的直接法,或在一抗后使用荧光标记二抗的间接法进行染色。间接法中二抗的反应时间、反应温度及清洗条件都要和一抗相同。接下来在染色后的再固定过程中要防止释放抗体发生反应。虽然多细胞球状体的尺寸较小,但能通过AbScale法的前处理使抗体充分渗透到内部。但是,一些抗体不易渗透,此时应尽量使用针对相同抗原的多种抗体进行检测。
下面介绍使用SCALEVIEW-A2试剂来透明化Nsp的新方法。由于SCALEVIEW-S4密度较高,容易使Nsp漂浮在液体中(简单地离心能沉淀出SCALEVIEW-A2溶液中的透明化Nsp),所以新方法不能使用SCALEVIEW-S4。
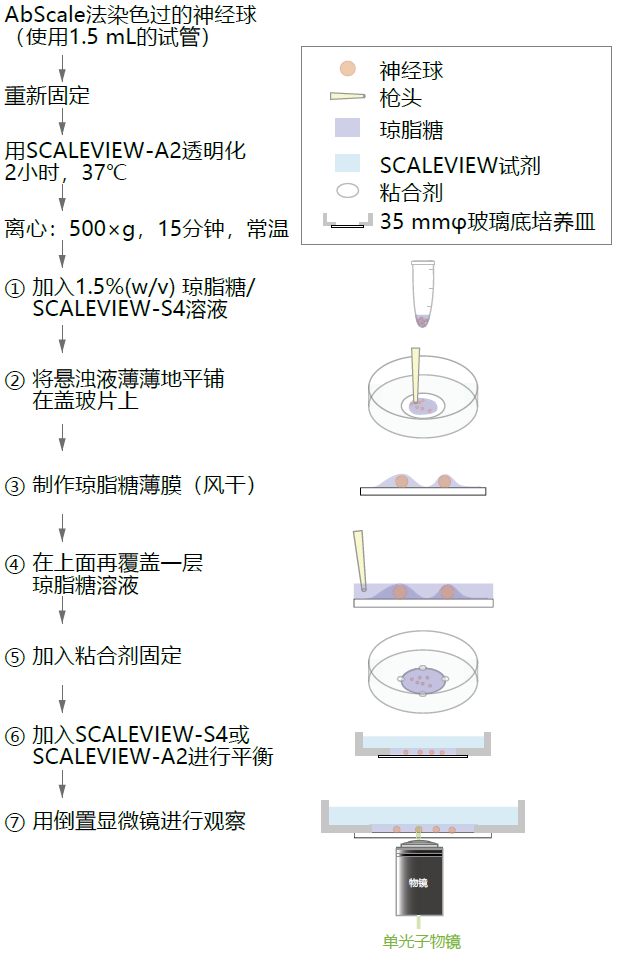
AbScale法进行染色、透明化、观察等一系列操作中,最需要注意的就是在用显微镜观察前的固定流程。作者将平时经常使用的琼脂糖固定流程总结在图2中。这个固定方法主要使用倒置显微镜,但观察时也可换成正置显微镜。
|
|
图片的详细顺序如下。
① 加入75 µL 1.5%(w/v) 琼脂糖/ SCALEVIEW-S4溶液,温度已降
① 至37~40 ℃。
② 将神经细胞球(以下称为Nsp)和琼脂糖的悬浊液转移到盖玻
① 片上。然后用移液枪的枪头将凝胶平铺成薄薄的一层。
③ 风干(10分钟,室温),使Nsp表面形成琼脂糖薄膜。
④ 风干后加入1.5%(w/v)琼脂糖/ SCALEVIEW-S4溶液(温度已降
① 至37-40°C),覆盖黏贴盖玻片的孔(约110 µL),再次风干
① (10分钟,室温)。接下来转入冰箱(4~8 ℃),使琼脂糖
① 凝固。
⑤ 用少量速干粘合剂固定成点状(横跨凝胶和培养皿的底部)可
① 以防止琼脂糖脱落。让粘合剂充分凝固。
⑥ 向培养皿中加入2 mL SCALEVIEW-S4或SCALEVIEW-A2,充
① 分摇匀并平衡(1~2小时,常温)。
⑦ 镜头靠近盖玻片并观察Nsp。
(补充)
ⅰ)推荐使用表面有硅胶涂层的枪头和试管(避免Nsp附着在试管
ⅰ)壁上造成的损失)。
ⅱ)熔解1.5%(w/v)琼脂糖/ SCALEVIEW-S4溶液时,要放入微波炉
ⅰ)加热(500 W,4~5分钟),并混合均匀,避免气泡进入。然后
ⅰ)用水流将瓶子温度冷却至37~40°C。
ⅲ)在风干的条件下,Nsp也不能在30~40 分钟内干燥。
|
|
图2. 观察三维免疫染色后的神经细胞球的固定实例
|
用上述方法将AbScale法免疫染色和透明化的Nsp固定后,观察到的图像如图3所示。该实验例子在样品的固定溶液中加入SCALEVIEW-A2,再用配备了10倍空浸物镜的倒置显微镜进行观察。结果表明,这种方法能顺利观察到直径约500 µm的Nsp整体及内部。特别是位于Nsp中间位置的最大直径区域可以很好地观察到免疫染色图像以及碘化丙啶(propidium iodide)染色的核染色图像,表明抗体和荧光素已充分渗透了整个Nsp。
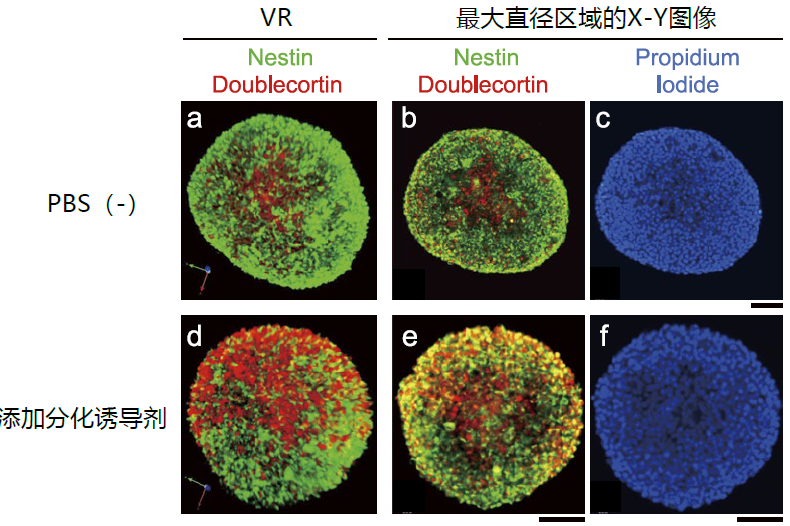
图3. 三维免疫染色后的细胞球观察图像
a.用(冷藏)储存的成年大鼠海马来源神经干细胞配制细胞球(Nsp)。培养后第5天加入分化诱导剂,2天后再用AbScale法进行染色和透明化,最后按照图2的方法,用倒置显微镜观察固定后的细胞球。免疫染色使用了nestin(图中绿色)及doublecortin (图中红色)的对应抗体。另外,本实验在进行透明化及观察时的浸液中都使用了SCALCEVIEW-A2试剂。
a.-c.是添加了PBS(-)的Nsp对照图像,d.-f.是添加了分化诱导剂的Nsp图像。
a.和d.是用碘化丙啶(propidium iodide)对免疫染色的三维重建图像进行核染色(图中蓝色)(作者将荧光色素的染色称为ChemScale)。
c.和f.是Nsp最大直径区域X-Y的碘化丙啶(propidium iodide)图像。比例尺为100 µm(b、c、e、f)。
作者相信根据上述使用方法,Scale法和AbScale法将有助于观察和分析多细胞球状体。
◆结语
现在为了有效推动研究发展,透明化技术正处于包括观察在内等一系列实际应用的构建阶段。由此看来看,关于Boutin团队[9] 开发的Scale法高通量分析多细胞球状体的相关报告,提出了一个很有趣的Scale法应用实例。
Scale法和AbScale法不仅能用于小鼠,还能应用于人的正常组织及病理组织。作者期待更多科研组织的研究人员能够使用这种方法,并希望本文对大家有所帮助。此外,如果希望了解更多Scale法进行组织透明化的详细内容,大家可以参阅作者的其他技术文章[10.11] 。
◆参考文献
[1] Hama, H. et al. : Nat. Neurosci., 14, 1481-1488 (2011).
[2] Hama, H. et al. : Nat. Neurosci., 18, 1518-1529 (2015).
[3] Economo, M. N. et al. : eLife, 5, e10566 (2016).
[4] Ye, L. et al. : Cell, 165, 1776-1788 (2016).
[5] Tainaka, K. et al. : Annu. Rev. Cell Dev. Biol., 32, 713-741 (2016).
[6] 日置寛之ら:「透明化技術の現状と今後の発展-ScaleS法に焦点を当てて」, 日薬理誌 149, 173-179 (2017).
[7] Iwano, S. et al. : Science, 359, 935-939 (2018).
[8] Hama, H. et al. : Protocol Exchange, doi : 10.1038/protex.2016.019 (2016).
[9] Boutin, M. E. et al. : Sci Rep., 8, 11135 (2018).
[10] 濱 裕ら:「組織の透明化技術」, 生体の科学, 68, 85-93 (2017).
[11] 濱 裕, 宮脇 敦史:「顕微鏡観察における組織透明化技術」, 生体の科学, 64, 595-601 (2013).
透明化技术 写在本系列前的话
在多方的配合协助下,“透明化技术”新信息的相关连载正式开始。借此机会对提供帮助的各位老师致以衷心的感谢!
活体组织的透明化技术能追溯到至今100多年以前,但日本近几年才兴起对透明化技术的研究。随着荧光蛋白观察和抗体观察的普及,显微镜技术不断革新的同时,透明化技术的开发也取得了长足的进展,研究人员可以按需选择合适的透明化技术。期待透明化技术能在生命科学研究中得到进一步的应用。
本系列将介绍更多活跃于透明化技术开发及应用研究领域的老师的研究成果。敬请期待!