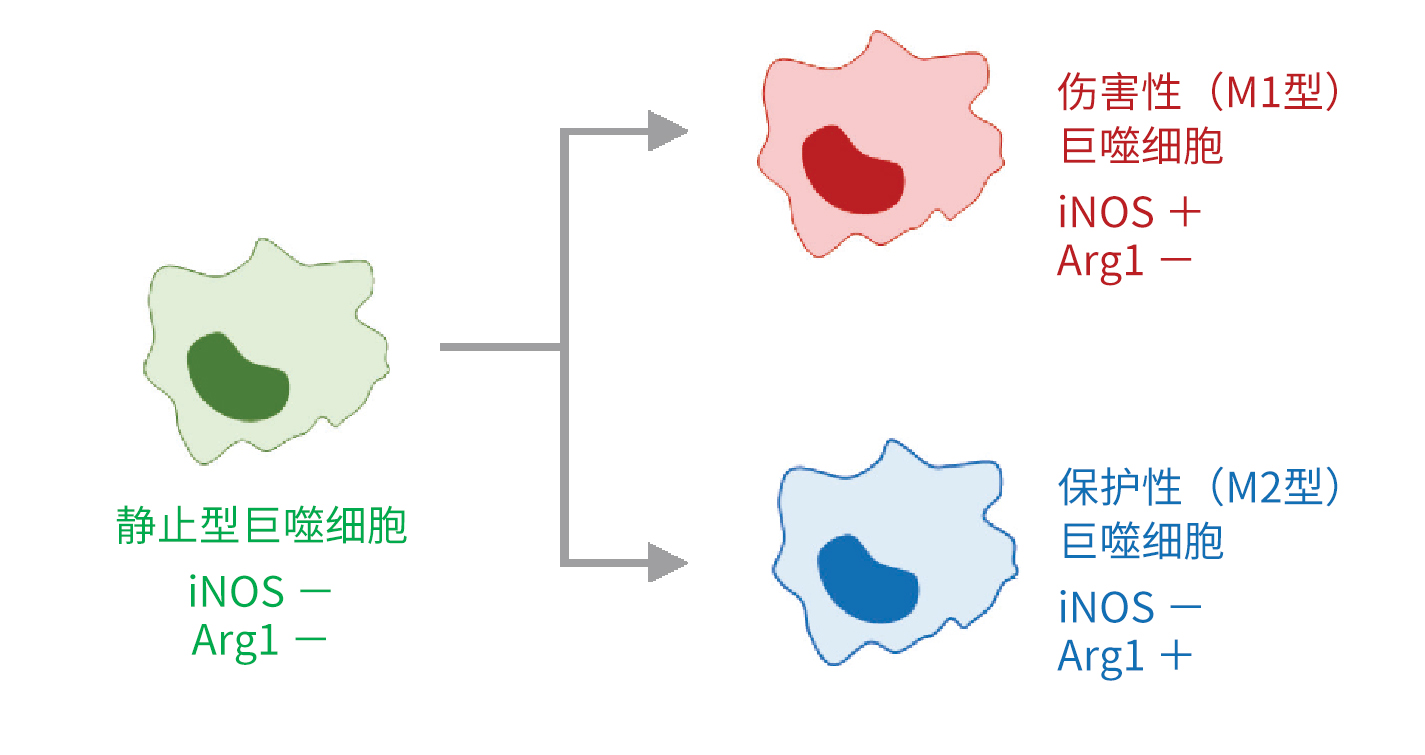
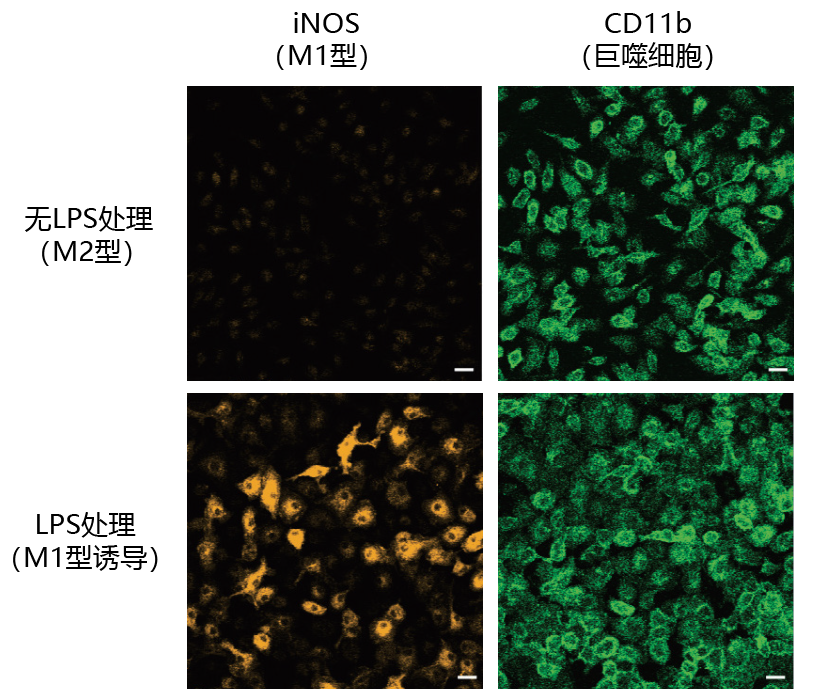
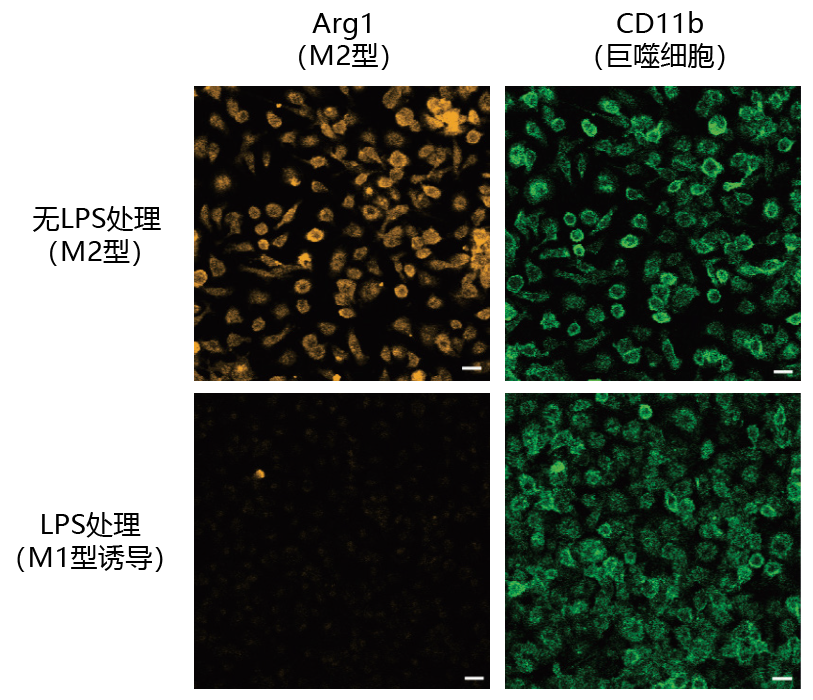
第4回 小胶质细胞和巨噬细胞在脑梗死后炎症和修复的控制机制
小胶质细胞研究的前沿 —从基础到临床—

东京都医学综合研究所 脑中风再生项目 庆应义塾大学药学系生化学讲座 大谷健人
东京都医学综合研究所 脑中风再生项目 日本医疗研究开发机构 七田崇
◆前言
在日本,脑梗死约占脑中风的80%,是造成植物人状态和死亡的的主要原因。脑梗死,是由于大脑血流量的减少使得向脑组织供应的氧气和营养物质不足,从而导致脑组织缺血性坏死(梗塞)。脑缺血会引起各种各样的细胞应激,炎症就是其中的应激反应之一。在脑缺血后的炎症中,常驻于脑组织中的巨噬细胞即小胶质细胞和伴随血脑屏障的破坏浸润脑组织的巨噬细胞会产生炎性细胞因子。
小胶质细胞和巨噬细胞对脑梗死后的炎症作用会持续数日,之后便不会再产生炎性细胞因子。但是,为了促进脑组织的修复,小胶质细胞和巨噬细胞的作用会发生改变。最近,关于小胶质细胞和巨噬细胞作为炎性细胞和修复细胞起作用的分子机制屡见报道。本文在讨论脑梗死后的炎症和通过巨噬细胞进行神经修复的分子机制的同时,还阐述了以小胶质细胞和巨噬细胞在脑梗死中的功能为靶点的治疗药物的开发前景。
◆在脑梗死后的炎症中小胶质细胞和巨噬细胞的作用
由于血脑屏障的破坏,在血液中循环的巨噬细胞会浸润脑组织。众所周知,巨噬细胞浸润大脑内少不了趋化因子,尤其是CCL2(C-C motif chemokine 2)与它的受体CCR2(C-C chemokine receptor 2)在巨噬细胞浸润脑组织时起着重要的作用1)。CCL2由缺血性脑组织中的细胞产生。研究发现,若缺损CCL2,巨噬细胞对脑组织内的浸润就会减弱,如果在抑制脑梗死病发后的早期抑制巨噬细胞浸润的话,可以减轻大脑内的炎症,达到保护大脑的效果2)。因此,我们认为CCL2-CCR2的相互作用对于炎性巨噬细胞的大脑内浸润非常重要。
如果由于缺血引起组织坏死的话,组成组织的物质就会被释放,而这些被释放的物质中含有会引起炎症的分子,被称为DAMPs(Damage-associated molecular patterns)3)。DAMPs会激活在小胶质细胞和巨噬细胞中表达的模式识别受体(Pattern recognition receptors : PRRs),从而引起脑梗死后的炎症(图1)。脑梗死后的主要DAMPs有HMGB1(High mobility group box1)和PRX(Peroxiredoxin)。
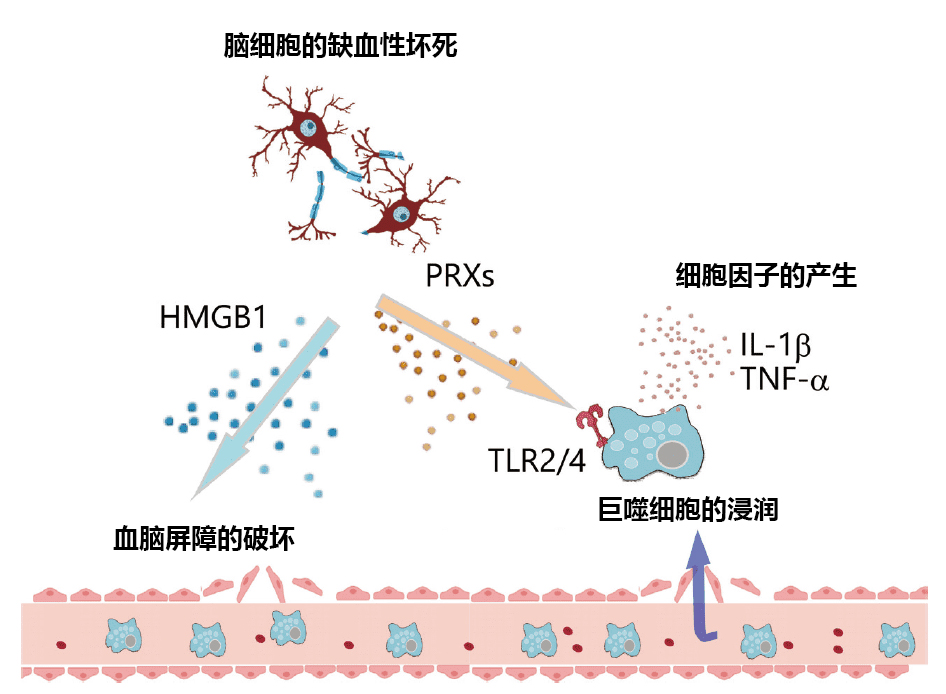
图1. 脑梗死后引起的炎症
从缺血性坏死的脑细胞中释放出HMGB1、PRX等DAMPs。HMGB1破坏血脑屏障,使得血液中的巨噬细胞浸润脑组织。DAMPs通过TLRs等模式识别受体激活小胶质细胞和巨噬细胞,诱导炎性细胞因子的产生,从而引起脑梗死后的脑水肿和进一步的神经损伤。
HMGB1 作为存在于细胞核内的DNA结合蛋白被发现。在脑组织中主要是神经细胞产生HMGB1,在脑缺血2~4 h后,可观察到HMGB1被释放至神经细胞外的状态4,5)。HMGB1使脑组织中MMP9(Matrix metalloproteinase 9)的表达升高,促进了血脑屏障的破坏从而导致炎症加重6)。而且HMGB1会激活中性粒细胞,诱导被称为NETs (Neutrophil extracellular traps)即中性粒细胞胞外诱捕网的释放7)。中性粒细胞胞外诱捕网是由基因组DNA和弹性蛋白酶、髓过氧化物酶等杀菌酶组成的复合物,被认为在感染和炎性疾病中具有排除病原体和加重组织中炎症的作用,由中性粒细胞和巨噬细胞释放8)。在脑梗死组织中也可以观察到NETs,被认为会加重脑梗死后的炎症和神经损伤。另外,在脑梗死后的血管中也可观察到NETs,在血管内释放NETs可能会促进血栓的形成,减少梗塞部位周围的脑血流量,加速神经症状的恶化。
PRX是细胞内将过氧化氢代谢成水的抗氧化蛋白。PRX在缺血后脑细胞中的表达升高,对氧化应激具有细胞保护的功能9)。另外,在细胞内积存的PRX被缺血性坏死的细胞释放至细胞外,激活小胶质细胞和浸润脑组织的巨噬细胞的模式识别受体,从而诱导炎性细胞因子的产生。
Myd88是在Toll样受体(Toll-like receptors : TLRs)的信号下游发挥作用的衔接分子,TLRs为主要的模式识别受体,在缺乏Myd88的小鼠中几乎丧失了TLRs的功能。用缺乏Myd88的小鼠制备脑梗死模型,发现浸润大脑的免疫细胞中的炎性细胞因子明显减少10)。众所周知,TLRs原本是通过识别细菌和病毒等病原体来源的分子来激活免疫细胞的,但它也能识别受损组织所释放的自身来源分子,引起无菌性炎症。
对于脑梗死,释放至细胞外的PRX会激活TLRs,诱导IL-1β (Interleukin-1β)、IL-23和TNF-α(Tumor necrosis factor α)等炎性细胞因子的产生。在啮齿类的脑梗死模型和脑中风患者中,研究人员认为这些炎性细胞因子会加重缺血后的炎症,引起脑水肿,并与神经损伤和预后不良相关11)。
◆脑梗死后巨噬细胞的炎症收敛作用
小胶质细胞和巨噬细胞在脑梗死后的炎症中起重要作用,但炎性细胞因子的产生只在脑梗死发病的几天后达到峰值,之后就会不断减少12)。在脑梗死发病后的几天至一周左右,巨噬细胞会促进炎症收敛作用,并为了有助于神经修复而发生功能变化13)。这些巨噬细胞会产生抗炎性细胞因子IL-10和TGF-β(Transforming growth factor β),具有神经保护作用。
在脑组织中,用腺病毒使IL-10过度表达,可以防止脑梗死后的神经细胞死亡和梗死体积扩大14)。TGF-β是具有炎症抑制作用的控制性T细胞分化的重要因子,可以减轻脑梗死后的炎症15)。如上所述,巨噬细胞在脑梗死中会产生炎症抑制性的因子。
从脑组织内排出DAMPs对于脑梗死后的炎症收敛非常重要。在小胶质细胞和巨噬细胞中表达的清道夫受体(MSR1或MARCO)可以识别PRX、HMGB1 等DAMPs,并将DAMPs从脑梗死组织中排出。在缺乏MSR1或MARCO的小鼠中,通过延迟DAMPs从脑梗死组织中排出,来延长炎症状态,可以发现其神经系统症状与野生型的小鼠相比更为严重16)。
MSR1在小胶质细胞和巨噬细胞中的表达,从脑梗死发病后的第1天到第3天会升高,像这样的MSR1表达升高,巨噬细胞分化的重要转录因子Mafb起了重要作用。在MSR1表达高的巨噬细胞中,比起TNF-α、IL-1β、IL-23等炎性细胞因子,主要还是产生像IGF-1(Insulin-like growth factor1)这样的神经营养因子16)。向脑梗死的大鼠给药苯酞衍生物,升高MSR1在浸润脑组织的巨噬细胞中的表达,促进DAMPs的排出。结果显示,TNF-α的产生减少了17)。因此,脑梗死后DAMPs的排出是使炎症收敛的重要过程。
脑梗死发病后经过7天左右,小胶质细胞和巨噬细胞会通过炎症收敛来促进修复,帮助脑梗死后的恢复18)。有报告称,巨噬细胞中缺乏CCR2的小鼠,脑梗死发病的几天后炎症会有所减弱,但发病5天后炎症会反弹,使神经症状加重,导致脑梗死后的恢复不佳13,19)。
脑梗死发病7天后,从小胶质细胞和巨噬细胞中产生IGF-1、FGF-2等有大脑保护作用的营养因子20,21)。由于这些营养因子参与髓鞘再生和突触形成,被认为对脑梗死后的恢复具有重要作用22)。像这样,浸润脑梗死组织的巨噬细胞被认为是通过从炎症性到炎症收敛和修复性的性质变化,来帮助脑梗死后的功能恢复。
◆以小胶质细胞和巨噬细胞为治疗靶点的脑梗死后的炎症控制
在脑梗死的急性治疗中,通过静脉内注射rt-PA(Recombinant tissue plasminogen activator)进行血栓溶解和血栓清除术23)。尚未验证免疫抑制剂类固醇、环孢菌素和他克莫司等对脑梗死患者功能预后的改善效果。因此,开发出既可以抑制脑梗死后的炎症又可以加速炎症收敛并促进修复的药物备受期待。
以IL-10 和TGF-β为治疗靶点的药物,除了难以诱导仅抗炎性细胞因子的表达外,在脑梗死中进行表达控制的合适时期还尚不明确。向脑梗死小鼠给药DHA(Docosahexaenoic acid)、IL-13和甲异靛(Meisoindigo),使小胶质细胞和巨噬细胞的性质改变为抗炎性和修复性24-26)。给药血管生成素后,炎性细胞因子的产生减少,观察到促进血管新生和保护大脑的效果27)。近期的报告显示,像PPARγ和STAT6 这样的转录因子可能是使脑梗死后炎症收敛的治疗靶点分子28)。
如果可以阐明使小胶质细胞和巨噬细胞的炎症收敛和修复作用持续进行的分子机制,将有可能开发出改善包含脑梗死等各种器官损伤的预后治疗药物。另外,虽然很少有可以在脑梗死发病24 h后才开始使用的治疗药物,但开发出在发病几天后才给药也能改善脑梗死后功能预后的治疗药物的可能性很高。
◆结语
小胶质细胞和巨噬细胞具有炎性、抗炎性、炎症收敛性和修复性等多种功能,在脑梗死后的不同时期对病情的发展起着重要的作用(图2)。可促进和维持小胶质细胞和巨噬细胞在脑梗死中炎症收敛和修复作用的新一代治疗药物的开发,正备受期待。
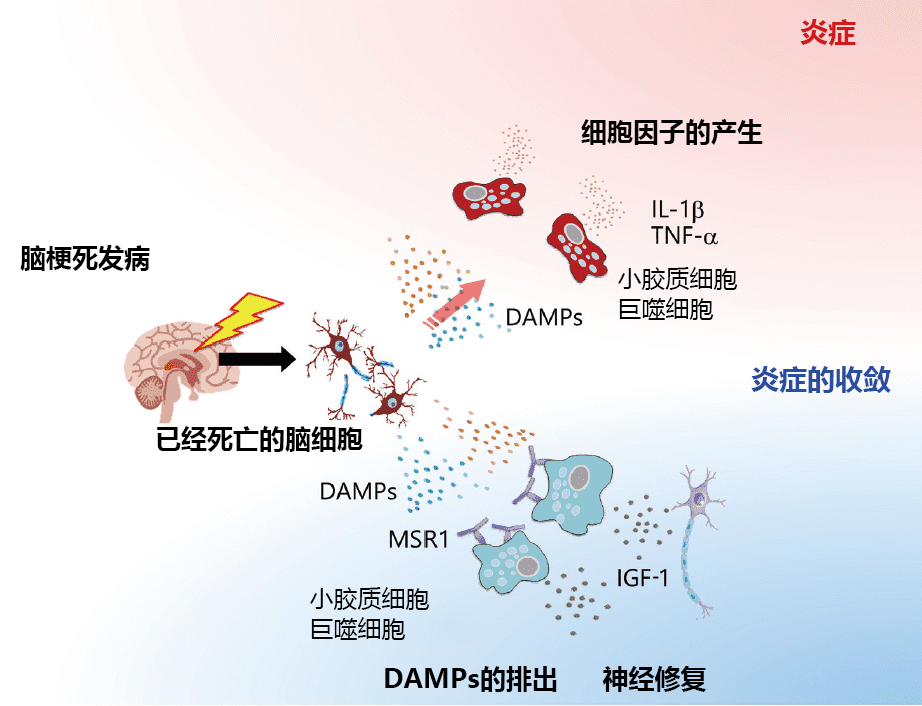
图2. 小胶质细胞和巨噬细胞在脑梗死中的多种功能和作用
脑梗死发病后,从缺血性坏死的脑细胞中释放的DAMPs,会激活小胶质细胞和巨噬细胞,从而产生IL-1β、TNF-α等炎性细胞因子。另外, MSR1表达高的小胶质细胞和巨噬细胞会从脑梗死组织中排出DAMPs,通过产生具有神经修复功能的IGF达到保护大脑的效果。
缩略语
CCL2:C-C motif chemokine 2;
CCR2:C-C chemokine receptor 2;
DAMPs:Damageassociated molecular patterns;
PRRs:Pattern recognition receptors;
HMGB1:High mobility group box1;
PRX:Peroxiredoxin;
MMP9:Matrix metalloproteinase 9;
NETs:Neutrophil extracellular traps;
TLRs:Toll-like receptors;
IL-1β:Interleukin-1β;
TNF:Tumor necrosis factor;
TGF-β:Transforming growth factor β;
IGF-1:Insulin-like growth factor1;
rt-PA:Recombinant tissue plasminogen activator;
DHA:Docosahexaenoic acid
Competing interests
The authors declare that they have no competing interests.
◆参考文献
1. Mildner, A. et al. : Nat. Neurosci., 10, 1544 (2007).
2. Gliem, M. et al. : Ann. Neurol., 71, 743 (2012).
3. Huang, J. et al. : Ageing Res. Rev., 24, 3 (2015).
4. Qiu, J. et al. : J. Cereb. Blood Flow Metab., 28, 927 ( 2008).
5. Zhang, J. et al. : Stroke, 42, 1420 (2011).
6. Qiu, J. et al. : Stroke, 41, 2077 (2010).
7. Ma, Y. H. et al. : Arthritis. Res. Ther., 18, 2 (2016).
8. Kim, S. W. et al. : Acta Neuropathol. Commun., 7, 94 (2019).
9. Rashidian, J. et al. : J. Neurosci., 29, 12497 (2009).
10. Shichita, T. et al. : Nat. Med., 15, 946 (2009).
11. Shichita, T. et al. : Nat. Med., 18, 911 (2012).
12. Clausen, B. H. et al. : Neuroscience, 132, 879 (2005).
13. Pedragosa, J. et al. : J. Cereb. Blood Flow Metab., 40, S98 (2020).
14. Ooboshi, H. et al. : Circulation, 111, 913 (2005).
15. Cekanaviciute, E. et al. : Glia, 62, 1227 (2014).
16. Shichita, T. et al. : Nat. Med., 23, 723 (2017).
17. Zou, X. et al. : J. Neuroimmune Pharmacol., (2020). doi:10.1007/s11481-020-09911-0.
18. Wattananit, S. et al. : J. Neurosci., 36, 4182 (2016).
19. Fang, W. et al. : Theranostics, 8, 3530 (2018).
20. Ikeda, N. et al. : Stroke, 36, 2725 (2005).
21. Zhu, W. et al. : Stroke, 39, 1254 (2008).
22. Leker, R. R. et al. : Stroke, 38, 153 (2007).
23. Hankey, G. J. : Lancet, 389, 641 (2017).
24. Ye, Y. et al. : Front. Cell. Neurosci., 13, 553 (2019).
25. Cai, W. et al. : Transl. Stroke Res., 9, 669 (2018).
26. Kolosowska, N. et al. : Neurotherapeutics, 16, 1304 (2019).
27. Venkat, P. et al. : CNS Neurosci. Ther., 27, 48 (2020).
28. Zhang, W. et al. : CNS Neurosci . Ther., 25, 1329 (2019).
◆小胶质细胞研究用Iba1抗体系列
|
产品编号
|
产品名称
|
来源
|
交叉反应
|
应用
|
规格
|
|
016-20001
|
Anti Iba1,Rabbit (for Western Blotting)
|
兔
|
小鼠,大鼠,人
|
WB
|
50 μg
|
|
019-19741
|
Anti Iba1, Rabbit (for Immunocytochemistry)
|
兔
|
小鼠,大鼠,人
|
ICH(F)
|
50 μg
|
|
013-27691
|
Anti Iba1, Rabbit(for Paraffin Section)
|
兔
|
小鼠,大鼠
|
ICH(P)
|
50 μg
|
|
012-26723
|
Anti Iba1, Monoclonal Antibody(NCNP24)
|
小鼠
|
小鼠(仅DAB),
大鼠,狨猴
|
ICH(F)
|
10 μL
|
|
016-26721
|
Anti Iba1, Monoclonal Antibody(NCNP24)
|
小鼠
|
小鼠(仅DAB),
大鼠,狨猴
|
ICH(F)
|
50 μL
|
|
013-27593
|
Anti Human Iba1, Monoclonal Antibody(NCNP27)
|
小鼠
|
人
|
ICH(P)
|
50 μL
|
|
017-27591
|
Anti Human Iba1, Monoclonal Antibody(NCNP27)
|
小鼠
|
人
|
ICH(P)
|
10 μL
|
|
011-27991
|
Anti Iba1, Goat
|
山羊
|
小鼠,大鼠
|
ICH(F)
|
100 μL
|
|
016-26461
|
Anti Iba1, Rabbit, Biotin-conjugated
|
兔
|
小鼠,大鼠
|
ICH(F)
|
100 μL
|
|
013-26471
|
Anti Iba1, Rabbit, Red Fluorochrome(635)-conjugated
|
兔
|
小鼠,大鼠
|
ICH(F)
|
100 μL
|
|
015-28011
|
Anti Iba1, Rabbit, SPICA Dye™ 568-conjugated
|
兔
|
小鼠,大鼠
|
ICH(F)
|
100 μL
|
◆神经炎症相关抗体
|
产品编号
|
产品名称
|
来源
|
交叉反应
|
应用
|
规格
|
|
AG-20B-0042
|
anti-Caspase-1(p20) (mouse), mAb (Casper-1)
|
小鼠
|
小鼠
|
WB(1 μg/mL), IHC(PS), IP
|
100 μg
|
|
AG-20B-0048
|
anti-Caspase-1 (p20) (human), mAb (Bally-1)
|
小鼠
|
人
|
WB(1 μg/mL)
|
100 μg
|
|
AG-20B-0014-C100
|
anti-NLRP3/NALP3, mAb (Cryo-2)
|
小鼠
|
人,小鼠
|
ICC,IHC,IP,WB(1 μg/mL)
|
100 μg
|
|
AG-25B-0006
|
anti-Asc, pAb (AL177)
|
兔
|
人,小鼠
|
ICC (1:200), IHC(P)(1:500),
IP (1:200),
WB (1:1000), Functional Application
|
100 μg
|
|
AG-20B-0044
|
anti-Caspase-1 (p10) (mouse), mAb (Casper-2)
|
小鼠
|
小鼠
|
WB (1 μg/mL)
|
100 μg
|
|
AG-20B-0060
|
anti-Caspase-4/11 (p20), mAb (Flamy-1)
|
小鼠
|
人,小鼠
|
WB (1 μg/mL), IP
|
100 μg
|
|
AG-20B-0064
|
anti-IL-1alpha (p18) (mouse), mAb (Teo-1)
|
小鼠
|
小鼠
|
WB (1 μg/mL),ELISA
|
100 μg
|
|
AG-20T-0137
|
anti-Caspase-8 (mouse), mAb (1G12)
|
大鼠
|
小鼠
|
ELISA, FC,
IHC, WB
|
100 μg
|
|
AG-20B-0057
|
anti-Caspase-8 (human), mAb (C15)
|
小鼠
|
人
|
WB (1 μg/mL),
IP,IHC
|
50 μg
100 μg
|
|
AG-25B-0036
|
anti-Gasdermin D (mouse), pAb (IN110)
|
豚鼠
|
小鼠
|
WB: (1:2000)
ELISA: (1:2000)
|
100 μg
|
※以上所有产品仅供实验研究用,不可用于人体,不可用作医药品、食品、临床诊断等。
![]()