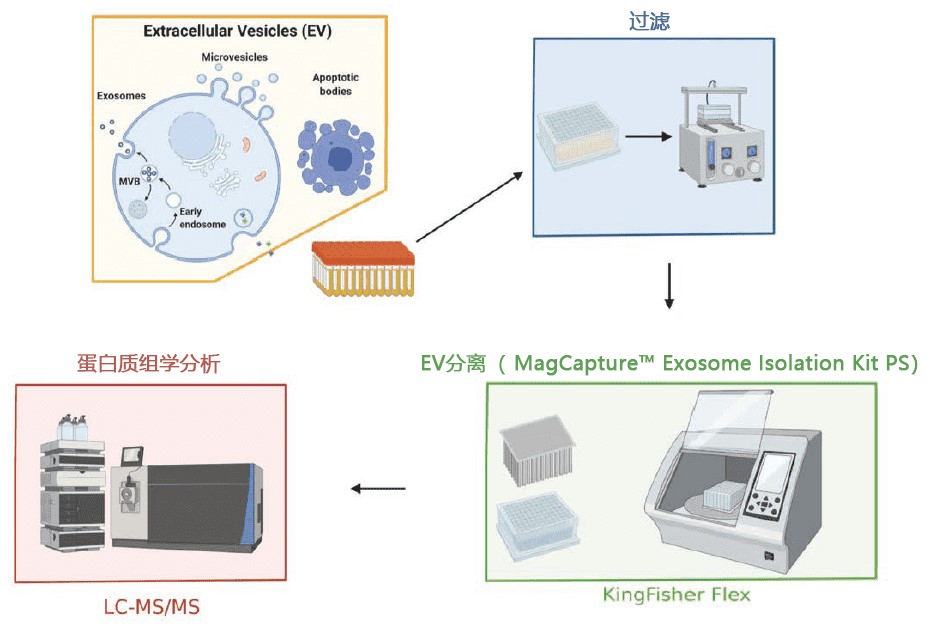
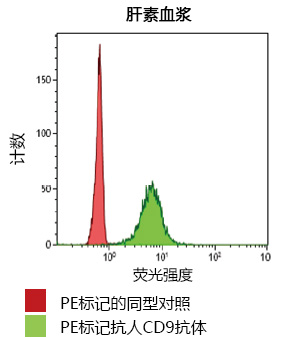
细胞外囊泡的荧光标记及其问题
富士フイルム和光純薬株式会社 生命科学研究所 請川亮
◆前言
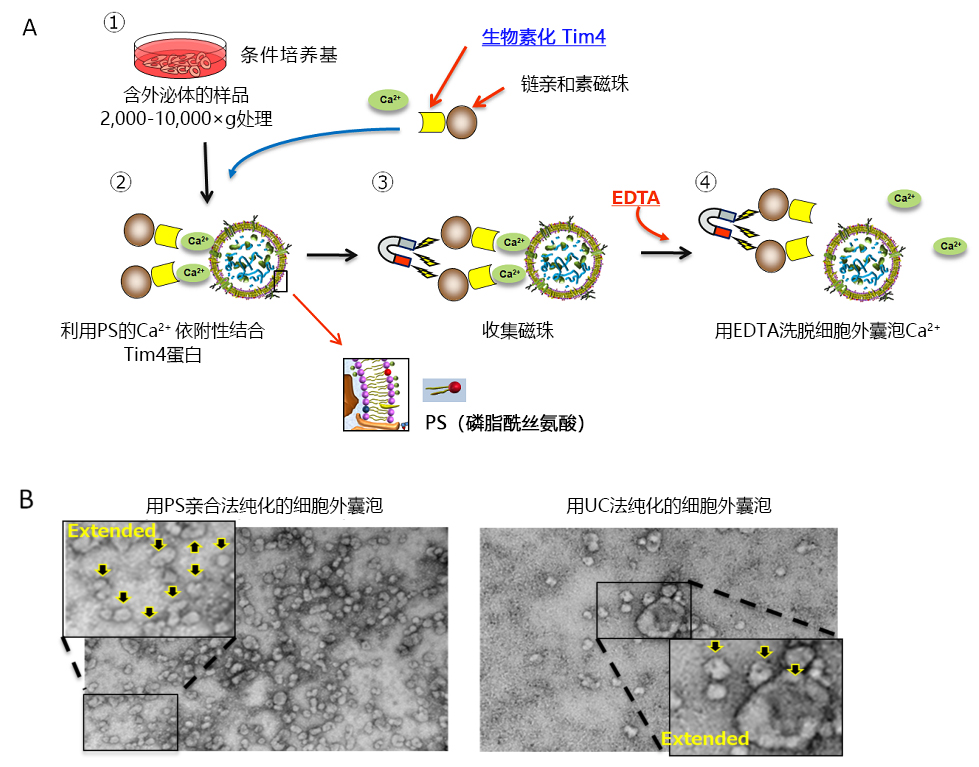
以外泌体为代表的细胞外囊泡是各个细胞释放出的膜囊泡,它作为细胞间信息传递的使者和疾病生物标志物,近年来受到了极高的关注1)。虽然近几年有关外泌体的研究在各领域中不断增长,但实验技术尚在发展阶段,还存在很多需要改善的问题。FUJIFILM Wako开发了一种新的亲和分离法——"PS亲和法",与传统方法相比,能从各种样品中提取出完整且高纯度的外泌体,而且,该技术还成功开发出用于外泌体检测的PS亲和ELISA 法2,3)。
在研究外泌体时,为了评价分离和提取出的外泌体的生物活性,通常会对细胞或动物进行投喂实验。利用荧光素标记进行可视化来确认对象中含有外泌体并进行追踪,是一种常见的技术。但是,如上述所说,外泌体的实验技术仍在发展,荧光素标记还存在需要注意的问题。本文讲述的是使用了不同品牌的荧光标记色素进行外泌体标记的研究,以及需要注意的问题。
◆在外泌体荧光标记实验中,去除未标记色素时的吸附损失
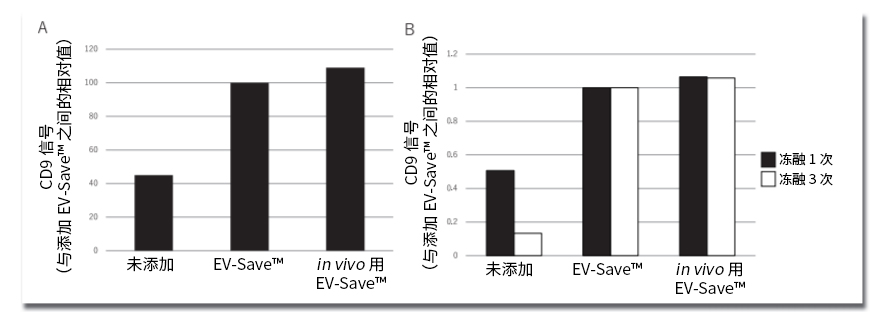
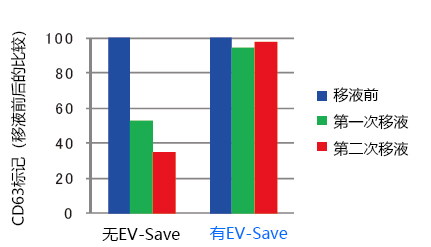
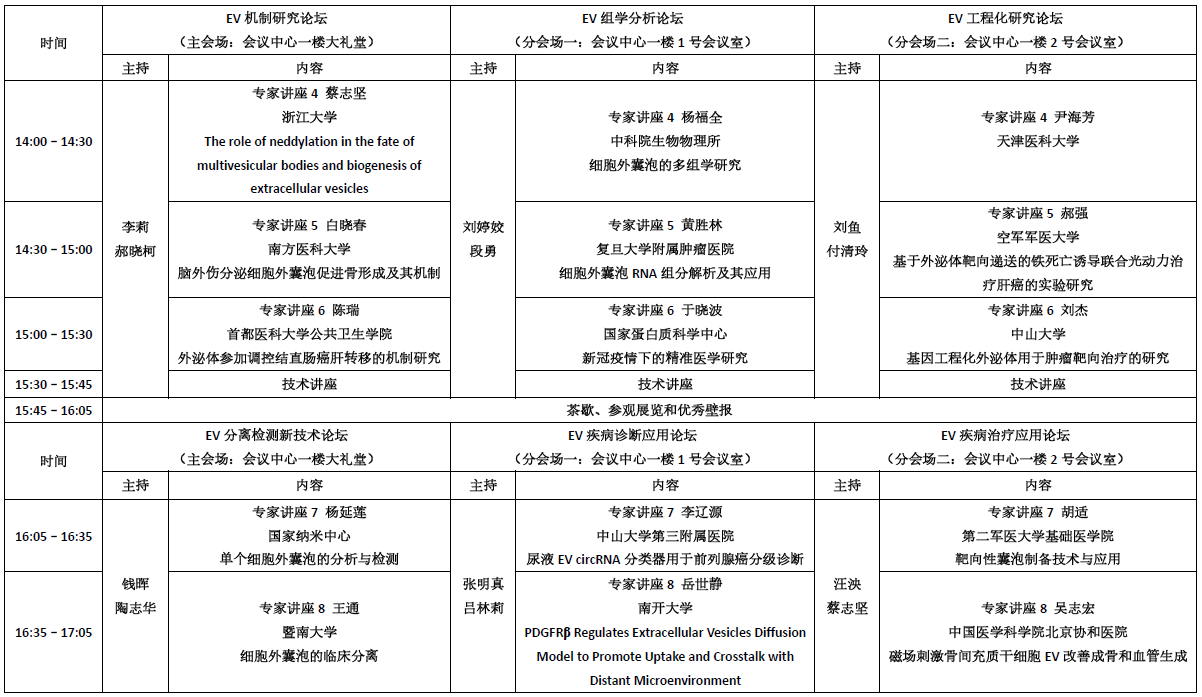
各品牌都将脂质、核酸或细胞膜的荧光标记试剂加以改造,使之成为包括外泌体在内的细胞外囊泡的特异荧光标记试剂。该标记方法是让从各个样品中分离、提取出来的外泌体样品与荧光色素进行反应,通过凝胶过滤或超滤装置去除未反应的荧光色素。在该荧光标记的过程中,特别是去除未反应的荧光标记时,会因吸附而损失大量的外泌体样品,同时,通过向外泌体样品添加FUJIFILM Wako开发的EV-Save™ Extracellular Vesicle Blocking Reagent(下面简称EV-Save),能强烈抑制吸附损失(图1)。用MagCapture™ Exosome Isolation Kit PS从COLO201细胞培养上清中分离、提取外泌体样品,先用A公司的荧光标记试剂进行标记,然后用B公司的凝胶过滤柱去除未反应色素。将获得的荧光标记外泌体样品加入HeLa细胞培养上清中,经过24小时的细胞吸收后,用荧光显微镜及流式细胞仪检测。在荧光色素标记时预先向样品中加入EV-Save,结果显示,细胞内的荧光信号比未添加EV-Save时大幅增强(图1、A, B)。用PS Capture™ Exosome ELISA Kit后再比较凝胶过滤前后外泌体样品的吸附损失, 未添加EV-Save的样品在凝胶过滤后没被检测到外泌体表面标记物CD63的信号,而添加了EV-Save的样品则检测到了CD63的信号,所以,EV-Save能有效抑制凝胶过滤引起的吸附损失(图1、C)。
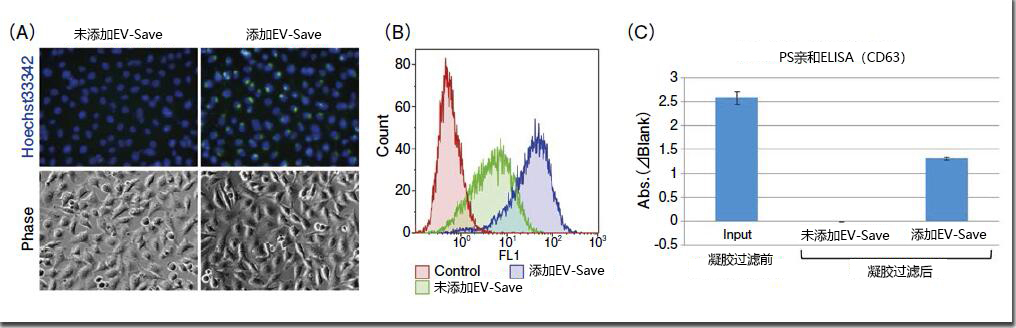
图1.荧光标记外泌体样品的吸收确认与EV-Save抑制吸附损失的效果
用A公司的荧光标记试剂对MagCapture™ Exosome Isolation Kit PS分离的COLO201来源外泌体样品(1 ×1010 particles)进行标记后,再用荧光显微镜(A)和流式细胞仪(B)确认HeLa细胞吸收外泌体样品的情况。
准备同上的外泌体样品(5 × 109 particles),可以用PS Capture™ Exosome ELISA Kit比较CD63信号来检测凝胶过滤前后的损失(C)。
◆使用了各种荧光标记试剂的外泌体染色方法及其特异性的问题
下面将对使用不同荧光标记试剂的外泌体荧光标记以及细胞的吸收能力进行比较。这次使用的是A、B、C公司的荧光标记试剂。用各种荧光标记试剂荧光标记以MagCapture™ Exosome Isolation Kit PS从COLO201细胞培养上清中提取的外泌体样品,再确认HeLa细胞对外泌体样品的吸收情况(图2、A, B)。荧光显微镜观察发现,细胞内吸收了用不同荧光标记的外泌体(图2、A),且根据流式细胞分析,比较无添加对照以及标记Elution buffer的阴性对照,峰值位移大幅改变,所以能确定受体细胞吸收了荧光标记的外泌体(图2、B)。但是,用荧光标记试剂来标记1% BSA 溶液作为阴性对照,与其他样品一样加入细胞后,和荧光标记的外泌体样品进行同样的处理,在流式细胞分析中也观察到了峰值的变化(图2、B)。对此,各种荧光色素标记试剂不仅对外泌体,同样的原理它对蛋白也能进行标记,故在用作外泌体标记试剂时,特异性是一个较严重的问题。从上述结果可见,用市面上销售的荧光标记试剂进行标记,或进行细胞吸收外泌体的确认实验时,受体细胞中的荧光信号是外泌体本身的信号,还是外泌体分离时受污染的蛋白等杂质来源的信号,解释结果时需要特别注意,故在进行细胞吸收外泌体的确认验证时,外泌体样品纯度非常重要。
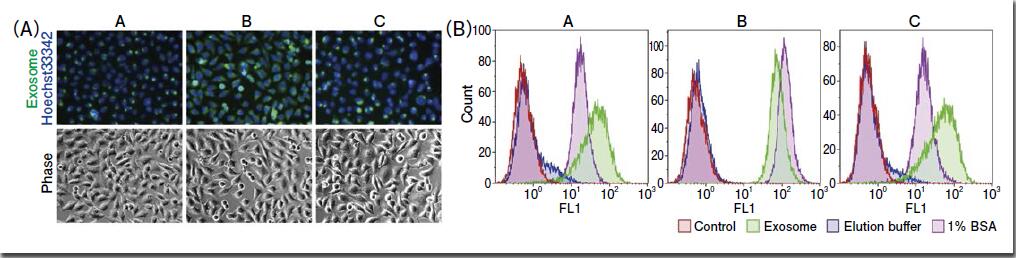
图2.使用了各种荧光标记试剂的外泌体标记与外泌体被HeLa细胞吸收的确认
用各种荧光标记试剂对MagCapture™ Exosome Isolation Kit PS分离的COLO201 来源外泌体样品(1× 1010 particles)进行标记,再用荧光显微镜(A)和流式细胞仪(B)确认HeLa细胞对外泌体样品的吸收情况。另外,作为对照,还准备了同样进行过荧光标记处理的试剂盒附带的Elution buffer和1%BSA 溶液,然后添加到细胞中(B)。
因此,通过FUJIFILM Wako PS亲和法和超离法从相同量的培养上清样品中分离、提取出外泌体样品,再用A公司的荧光标记试剂标记外泌体样品,进行细胞吸收外泌体的确认实验(图3)。荧光显微镜的分析结果表明,受体细胞吸收的由超离法分离、提取出的外泌体样品比PS亲和提取的外泌体样品更多(图3、A)。但是,详细分析提取外泌体样品时,尽管蛋白浓度和粒子数分析显示出超离样品含有更多的外泌体量,但是如果用PS Capture™ Exosome ELISA Kit检测外泌体标记物CD63信号,PS亲和法分离、提取的样品比用超离法分离、提取的外泌体样品的一个粒子的CD63信号和纯度更高(图3、B)。使用杂质多、污染严重的超离法制备外泌体样品时,受体细胞吸收的信号实体不仅来源于外泌体,也可能来源于杂质蛋白。
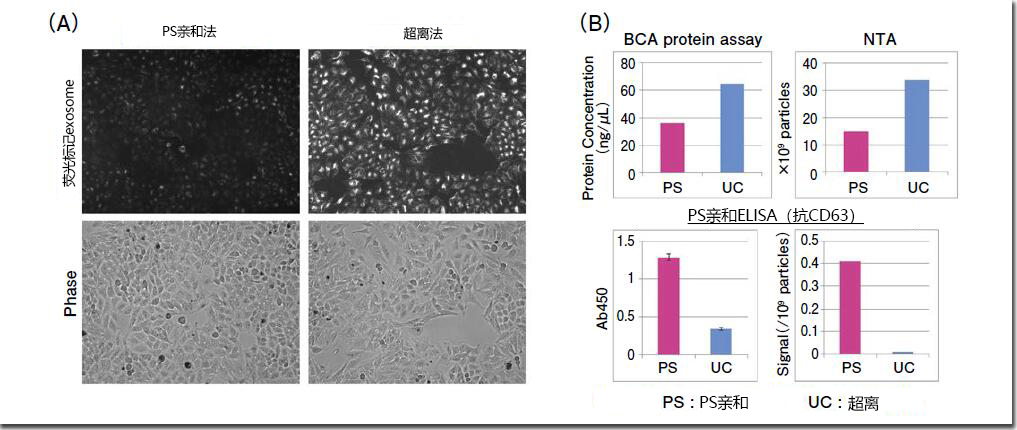
图3.比较PS亲和提取与超离提取外泌体的吸收的效率
用A公司的荧光标记试剂对用MagCapture™ Exosome Isolation Kit PS和超离法分离的COLO201 来源的外泌体样品(8 × 109 particles)进行标记,然后在荧光显微镜下比较HeLa细胞吸收外泌体的效率(A)。各提取法配制的外泌体样品,以BCA assay 检测蛋白浓度,使用NanoSight的NTA检测粒子数,同时,通过PS亲和ELISA法检测CD63的信号(B)。
◆结语
在进行外泌体的荧光标记法和细胞吸收外泌体的确认时应该注意的两点是,外泌体具有的吸附特性与收量低下密切相关,现在市面上销售的荧光标记试剂不是以外泌体染色为目的而开发的,对外泌体的特异性较低。对于如何配制高纯度的外泌体样品,本文提出了分离、提取方法的重要性。但是至今为止,如多数论文报告主要采用的那样,分离、提取含有外泌体的细胞外囊泡的方法的黄金标准仍然是超离法,但实际上,超离法配制出的外泌体样品会混入很多非细胞外囊泡来源的杂质蛋白,我们仍在继续彻底评估污染物对下游实验结果的影响。International Society for Extracellular Vesicles的杂志《Journalof Extracellular Vesicles》也提到过这个问题4)。以FUJIFILM Wako开发的"PS亲和法"为基础的MagCapture™ Exosome Isolation Kit PS还有待改善,但它比超离法和各种分离、提取试剂盒能相比,能更简便地提取高浓度的外泌体。衷心希望在未来FUJIFILM Wako的产品能有助于以外泌体为代表的细胞外囊泡研究的进一步发展。
◆参考文献
1) Tkach, M. et al . : Cell , 164, 1226(2016).
2) Nakai, W. et al . : Sci. Rep ., 6, 33935(2016).
3) Saito, S. et al . : Sci. Rep ., 8, 3997(2018).
4) Gardiner C. et al . : J. Extracell. Vesicles , 5, 32945(2016)
◆产品列表
| 产品编号 | 产品名称 | 规格 | 包装 |
| 058-09261 | EV-Save™ Extracellular Vesicle Blocking Reagent EV-Save™ 细胞外囊泡吸附抑制剂 |
基因研究用 | 1mL |