上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
特点:
● 可以在大约3个小时内制备ALP标记的产品。
● 可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
● 可以标记50至200μg的蛋白质。
● 只需与NH2反应性ALP混合即可形成ALP标签。
● 可以通过使用过滤管的分离操作以高回收率获得标记物质。
● 带有ALP标签的产品可以与随附的存储溶液一起存储。

试剂盒内含

产品概述
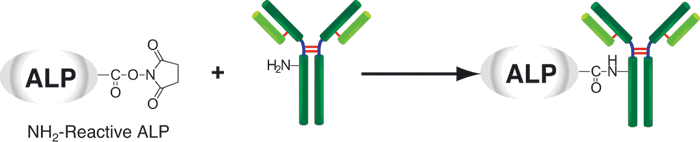
该试剂盒主要用于制备酶免疫分析 (EIA) 所需的碱性磷酸酶标IgG以及竞争性EIA所需的碱性磷酸酶标抗原。该试剂盒中的NH2-reactive ALP能够与含有NH2的蛋白质或者其他分子反应。该试剂盒包含了标记过程中所需的全部试剂,包括储存用缓冲液。NH2-reactive ALP不需任何活化就可以和靶分子结合。因此,当碱性磷酸酶标IgG用于EIA时,NH2-reactive ALP的高效性足以使它在标记后省去纯化的过程。即使在标记后需要有一个高纯度的精制过程,也只要用亲和柱或凝胶渗透柱就能简单达到目的。在标记小分子的时候,使用试剂盒中包含的过滤管即可除去分子量较大的分子。
*ALP:Alkaline Phosphatase (碱性磷酸酶)
备注:经过同仁化学研究所的长期稳定性考验,代码为LK12的产品在0-5℃未开封的条件下由原来可以保存半年延长至一年。
原理
操作步骤
使用注意事项:
1.所需标记的较大的蛋白质的分子量要>50,000。
2.所需标记的较小的氨基化合物的分子量要<5,000。
3.标记过程中,标记前后的IgG总是在过滤管的滤膜上。
4.如果IgG溶液含有其它分子量超过10,000的蛋白质,如BSA或凝胶,在使用该试剂盒标记前请先纯化IgG溶液。IgG溶液能够使用IgG纯化试剂盒来纯化 (不包含于此试剂盒中)。
5.如果IgG溶液中含有小的不溶物,离心后提取上清液来标记。
6.如果长时间不使用,建议您把试剂盒中的酶NH2-reactive ALP放在-20℃冰箱中保存,不需要充氮气,可以更好地保持酶的活性,但请不要把其它试剂和过滤管放到-20℃冰箱中,仍请放在0-5℃冰箱中保存。
标记IgG操作步骤:
(1)将100μl Washing buffer以及含有50-200μg IgG的样品溶液加入到过滤管中。a)
(2)8,000-10,000g离心10分钟后,加入100μl Washing buffer再离心一次。b)
(3)将10μl Reaction buffer加入到NH2-reactive ALP中并用移液器吹打使其溶解。
(4)将含有NH2-reactive ALP的溶液转移到IgG所集中的过滤管的滤膜上。
(5)用移液器吸取溶液吹洗净整个滤膜表面,然后将过滤管放入培养箱中,37℃培养2小时。
(6)加入190μl Storage buffer 并吹打10到15次来回收标记产物。c)将溶液转移至0.5ml的试管中,并储存于0-5℃下。d)

a)推荐的IgG的量为100μg,样品溶液的体积不应超过100μl。如果抗体浓度低于0.5mg/ml,重复步骤1和2直至总的IgG聚积量达到50-200μg。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记后共轭物的浓度为0.5-1.3mg/ml。在进行后续的酶免疫,免疫印迹,免疫转染试验前先要将标记后的IgG稀释至适当的浓度。每个IgG分子上会被标记上1到3个碱性磷酸酶分子。没有被结合的碱性磷酸酶不会干扰正常的免疫试验。如果一定要纯化的话,可以使用凝胶渗透柱或亲合柱。
d)通常,碱性磷酸酶标记后的IgG在Storage buffer中,0-5℃下至少能够保存2个月,如果需要保存更久,可以在-20℃下存放。但还要注意样品自身是否稳定。
标记小分子操作步骤:
(1)用Reaction buffer制备50μl,1mM的氨基化合物溶液,a)并将该溶液加入到NH2 -Reactive ALP管中。吹打数次使其充分混合,然后置于37℃下培养1小时。
(2)将100μl Washing Buffer加入到反应液中并将整个溶液全部移入过滤管中。
(3)在8,000-10,000g离心10分钟,b)弃滤液,向管中加入200μl Washing Buffer。再重复该过程一次,然后再在8,000-10,000g离心10分钟。b)
(4)加入200μl Storage buffer并用移液器吹打10到15次来回收标记产物。c)将此溶液转移至微型管中,并储存于0-5℃下 d)。

a)如果氨基化合物在水溶液中无法溶解,可以用DMSO使其溶解,制备成10mM的溶液,取5μl与45μl Reaction buffer混合。
b)如果溶液在离心后仍然残留在膜上,可以再离心5 min或者适当增加转速直至膜上没有残留液体。
c)标记后产物的浓度大约为400-500μg/ml(10-12.5μM)。1-2个靶分子能够和1个碱性磷酸酶分子结合。
d)建议用Storage Buffer来回收标记产物,也可以选择其它合适的缓冲液。
产品优势
1)可以在大约3个小时内制备ALP标记的产品。
2)可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
3)可以标记50至200μg的蛋白质。
4)只需与NH2反应性ALP混合即可形成ALP标签。
5)可以通过使用过滤管的分离操作以高回收率获得标记物质。
6)带有ALP标签的产品可以与随附的存储溶液一起存储。
常见问题Q&A
| Q1: 能够使用这个试剂盒标记Fab或者Fab’吗? |
| A:可以标记。并且回收率通常都超过80%。 |
| Q2:能够用这个试剂盒标记其他蛋白质吗? |
| A:可以。只要标记分子的分子量>50,000或者<5,000且具有活性氨基结构。如果分子量>50,000,参照IgG的标记操作说明,使用0.5-1 nmol蛋白样品用LK12来标记。如果分子量<5,000,参照标记小分子的操作说明。如果分子量>5,000且<50,000,请咨询我们的客户服务。Email:info@dojindo.cn 免费电话:800-988-0083 |
| Q3: 能够使用这个试剂盒标记寡核苷酸或者寡肽吗? |
| A:可以,只要它的分子量<5,000且具有活性氨基。可以参照标记小分子的操作说明。 |
| Q4:LK12所能标记的最小的IgG的量是多少? |
| A:最小量为50 μg。标记50 μg与200 μg之间的IgG,在灵敏度和本底上没有太大的区别。尽管这个试剂盒也能标记10 μg的IgG,但是本底会较高。 |
| Q5: 每个IgG能够标记多少碱性磷酸酶分子? |
| A:每个IgG平均能标记上1-2个碱性磷酸酶分子。 |
| Q6:标记反应结束后,未反应的NH2-reactive ALP是否还具有活性? |
| A:没有了。NHS在反应过程中会完全被水解。 |
| Q7:标记反应过程中,NH2-reactive ALP是否会形成一些低聚物? |
| A:不会。由于NH2-reactive ALP中的所有活性氨基都被阻断,因此不会有低聚物生成。 |
| Q8:是否必须要使用试剂盒所包含的Storage Buffer? |
| A:不一定要使用试剂盒所包含的Storage Buffer。可以选择任何适用于该试验的缓冲液。但是,Storage Buffer能够提高标记产物的稳定性。 |
| Q9:Storage Buffer中是否含有动物产品或者高分子聚合物? |
| A:Storage Buffer中不含有任何动物产品,高分子聚合物或者重金属离子。 |
参考文献
1) B. Pandey, A.V. Demchenko, K.J. Stine, “Nanoporous gold as a solid support for protein immobilization and development of an electrochemical immunoassay for prostate specific antigen and carcinoembryonic antigen”, Microchim Acta., 2012, 179, (1-2), 71.
2) M. Watanabe, I. Takemasa, N. Kaneko, Y. Yokoyama, E. Matsuo, S. Iwasa, M. Mori, N. Matsuura, M. Monden, and O. Nishimura, “Clinical significance of circulating galectins as colorectal cancer markers”, Oncol. Rep.., 2011, 25, (5), 1217.
3) Y. Matsumae, Y. Takahashi, H. Shiku and T. Matsue, “Quantitative Real‐Time Monitoring of Antibody‐Induced Internalization of Epidermal Growth Factor Receptor on Single Living Mammalian Cells Using Scanning Electrochemical Microscopy”, ChemElectroChem., 2018, 5, (20), 3096.
