上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
C35H37ClN2Si
549.22
特点:
● 能够对活细胞进行荧光成像
● 对单线态氧的高选择性


产品概述
单线态氧(Singlet Oxygen,1O2)是一种具有强氧化性的活性氧(ROS),是造成皮肤斑点及皱纹的重要因素。在化妆品等研究中,去除单线态氧是重要的研究目的。在癌症研究领域,单线态氧在光动力疗法(PDT:一种采用光敏药物和激光活化治疗肿瘤的新兴抗癌疗法)中起到关键作用。因此检测活细胞内的单线态氧对于了解PDT的抗癌机理至关重要。但是现有的荧光探针由于不能穿透细胞膜,所以无法用于活细胞检测。
Majima等人合成了一种由含硅罗丹明和蒽环构成的新型远红外荧光探针Si-DMA,分别作为发色团和单线态氧反应位点。当存在单线态氧时会在Si-DMA的蒽环部位生成内过氧化物,Si-DMA的荧光强度会增强1)。在7种不同活性氧中,Si-DMA能够特异性地检测单线态氧(图3)。另外在用5-氨基乙酰丙酸(5-ALA,一种血红素前体)处理细胞后,Si-DMA可以实时观察到线粒体中原卟啉IX产生单线态氧的变化情况(图4)。
原理
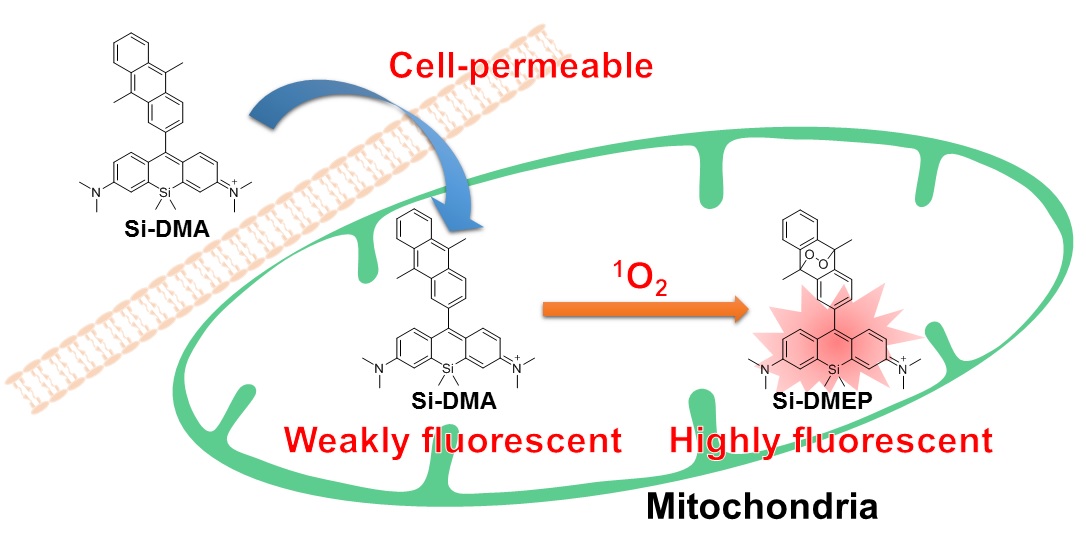
图1. Si-DMA的细胞染色原理
荧光特性
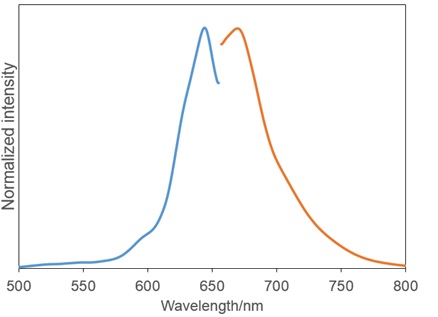
图2. Si-DMA与单线态氧反应后的激发和发射光谱
反应特异性
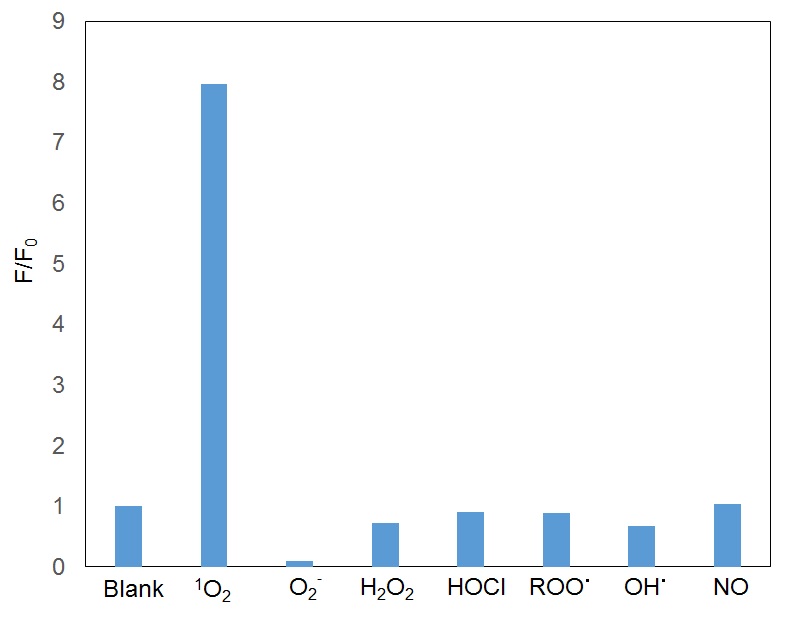
图3. Si-DMA对各种ROS的选择性
实验例
实验例1 荧光显微镜观察用5-氨基乙酰丙酸 (5-ALA) 处理后的HeLa细胞中的单线态氧
1. 接种200 μl HeLa细胞 (2.4×105 cells/ml) 在μ-slide 8孔板 (ibidi) ,培养基为DMEM (10%FBS,1%青霉素-链霉素),
在37℃ 5% CO2培养箱中过夜培养。
2. 用200 μl Hanks’ HEPES 缓冲液洗涤细胞2次。
3. 在μ-slide 8孔板中加入200 μl 含5-ALA的Hanks’ HEPES 缓冲液 (150 μg/ml),在37℃ 5% CO2培养箱中培养4 h。
4. 用Hanks’ HEPES 缓冲液洗涤细胞2次。
5. 加入200 μl Si-DMA工作液(40 nmol/l), 在37℃ 5% CO2培养箱中培养45 min。
6. 用200 μl Hanks’ HEPES缓冲液洗涤细胞2次。
7. 加入200 μl Hanks’ HEPES缓冲液,并用荧光显微镜进行观察。
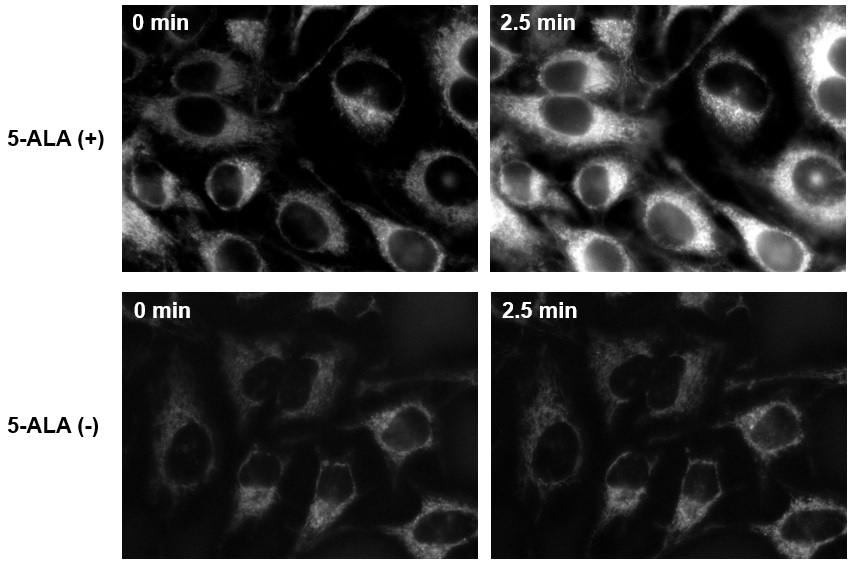
Si-DMA检测5-ALA处理的HeLa细胞线粒体中的单线态氧的荧光成像
5-ALA处理过的HeLa细胞经过2.5 min照射后,Si-DMA的荧光增强,因此Si-DMA可以用于实时监测线粒体中原卟啉IX产生的单线态氧。
滤镜 (波长/带通型滤光片)
荧光成像:600±25 nm (Ex), 685±25 nm (Em)
实验例2 线粒体中的单线态氧检测
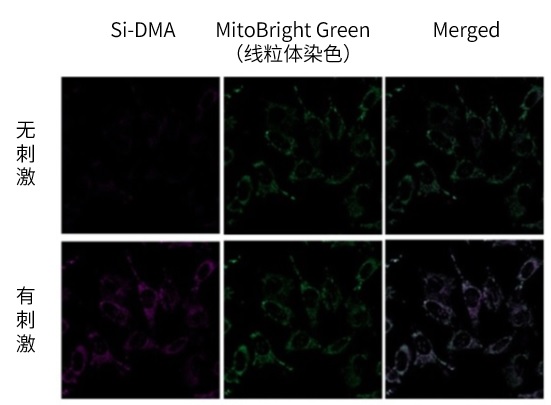
用终浓度为50 μmol/l的过氧化氢和终浓度为50 μmol/l的次氯酸刺激或不刺激HeLa细胞,用Si-DMA检测到细胞中产生的单线态氧。和线粒体染料(MitoBright Green: MT06)共染,特异性地在线粒体中检测到了单线态氧。
波长(激发波长/发射波长)
Si-DMA: 600±25 nm/685±25 nm
MitoBright Green: 488 nm/501-563 nm
实验例3 观察用H2O2处理Primary Hepatocytes细胞后产生的单线态氧
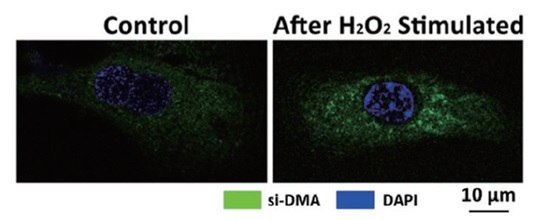
Si-DMA检测用H2O2刺激Primary Hepatocytes细胞后产生的单线态氧荧光成像
实验条件:
用10 mM H2O2刺激Primary Hepatocytes 20 min。
细胞数量:1×104/dish
容器:Nest 15 mm共聚焦培养皿801002
染色条件:在37℃ 5% CO2培养箱中染色45 min
Si-DMA工作液浓度:100 nmol/l
检测仪器:激光共聚焦显微镜
仪器品牌:Leica,Cambridge, UK
仪器型号:BMI-6000
Ex:600 nm,Em: 685 nm
(以上数据由东方肝胆外科医院信号转导实验室友情提供)
常见问题Q&A
| Q1、本试剂盒与现有方法相比有什么优势? |
| A1:本试剂盒的优点是“能够对活细胞进行荧光成像”和“对单线态氧的高选择性”。在操作说明中有详细的实验数据。 |
| Q2、DMSO Stock Solution的稳定性怎么样? |
| A2:DMSO Stock Solution配制后在-20℃及避光条件下可以保存大约1个月,建议根据每次的用量进行分装保存。 |
| Q3、配制Working Solution可以用Hanks’ HEPES以外的缓冲液吗? |
| A3:还可以用HBSS缓冲液。 |
| Q4、Working Solution的稳定性怎么样? |
| A4:Working Solution不稳定,请在配制当天使用。 |
参考文献
1、S. Kim, T. Tachikawa, M. Fujitsuka, T. Majima, “Far-Red Fluorescence Probe for Monitoring Singlet Oxygen during Photodyanamic Therapy”, J. Am. Chem. Soc., 2014, 136 (33), 11707.
2、S. Bekeschus, A. Mueller, U. Gaipl, KD. Weltmann, “Physical plasma elicits immunogenic cancer cell death and mitochondrial singlet oxygen”, TRPMS., 2017, 99, DOI:10.1109/TRPMS.2017.2766027.
3、Y. D. Riani, T. Matsuda, K. Takemoto and T. Nagai, “Green monomeric photosensitizing fluorescent protein for photo-inducible protein inactivation and cell ablation “, BMC Biol, 2018, 16, 50.
4、T. Guo, T. Liu, Y. Sun, X. Liu, R. Xiong, H. Li, Z. Li, Z. Zhang, Z. Tian, and Y. Tian, “Sonodynamic therapy inhibits palmitateinduced beta cell dysfunction via PINK1/ Parkin-dependent mitophagy”, Cell Death Dis., 2019, 10, 457.
5、K. Murotomi, A. Umeno, S, Sugino and Y. Yoshida. , “Quantitative kinetics of intracellular singlet oxygen generation using a fluorescence probe”, Sci Rep, 2020, 10, 10616.
6、Y. Fujita, M. Iketani, M. Ito, I. Ohsawa, “Temporal changes in mitochondrial function and reactive oxygen species generation during the development of replicative senescence in human fibroblasts”, 2022, doi:10.1016/j.exger.2022.111866.
关联产品
