生物制药中宿主细胞来源残留DNA检测试剂的开发
![]()
富士胶片和光纯药株式会社 生产工艺开发部 山本阳太郎
◆前言
自1982年世界首款糖尿病治疗药“人胰岛素“开发以来,生物药制剂的数量也在不断增加,截止2018年,市场上共有316种生物制剂1)。相信在未来,生物药制剂的数量也还会持续增加。Walsh等研究人员总结得出,获批上市的药物中,使用CHO和大肠杆菌作为宿主细胞的约占70%1)。综上所述,随着生物药在社会上的不断发展普及,关于重组蛋白以及抗体药物品质管理的相关法规也相继建立。本文将介绍我们开发的宿主细胞来源残留DNA检测试剂。
◆QCdetect™ 残留DNA检测试剂盒
为确保生物制药的安全和品质,需要一个可迅速且准确的筛选方法来检查生产过程中的污染物和杂质。由于生产用宿主细胞来源的残留DNA会诱发癌症和不必要的免疫反应,世界卫生组织(WHO)和美国食品药品监督管理局(FDA)等监管机构建议,非口服药剂的残留DNA含量不应超过10 ng/剂。此外,FDA还建议,残留DNA检测方法的灵敏度应≥10 pg/剂2,3,4)。
为满足监管机构的要求,FUJIFILM Wako的QCdetect™ 残留DNA检测试剂盒采用了双重标记探针的Quantitative PCR(qPCR),内含确认qPCR成功与否的Internal control(IC,内标)assay。另外,为尽可能减少实验人员的操作,还开发了无需制备即可使用的Master mix。
qPCR 中最重要的引物和探针靶向的序列以多个拷贝存在,通过针对性地设计目标领域,保证了灵敏度和特异性。CHO细胞用探针性能参考图1A和B,大肠杆菌用探针性能请参考图1C和D。结果显示,CHO可检测出0.3 fg,E. coli可检测出30 fg,因此可检测低于10 pg的量,由此可见,试剂盒可进行高灵敏度且检测范围广的实验。
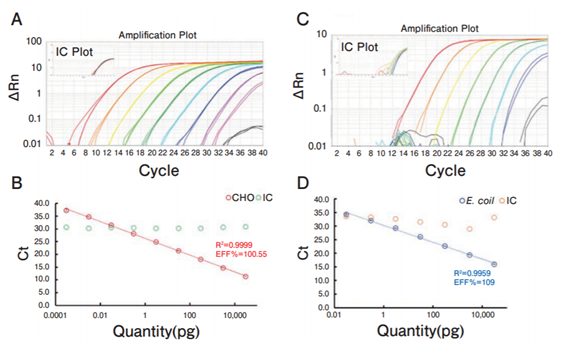
图1. QCdetect™ 残留DNA检测试剂盒,CHO用细胞和大肠杆菌用的检测范围和灵敏度
A:CHO gDNA 30,000 ~ 0.0003 pg 的增幅曲线(10倍稀释梯度)
B:CHO gDNA 30,000 ~0.0003 pg 的标准曲线(10倍稀释梯度)
C:大肠杆菌gDNA 30,000~0.03 pg 的增幅曲线(10倍稀释梯度)
D:大肠杆菌gDNA 30,000~0.03 pg 的标准曲线(10倍稀释梯度)
◆QCdetect™ 残留DNA检测试剂盒的可靠性
在实际生产中检测的宿主细胞来源残留DNA在培养,纯化过程中一般会出现片段化。本产品使用超声波破碎处理genome DNA(gDNA),比较在约300 bp以下的片段中制备的溶液和未处理的gDNA溶液,结果如图2所示。超声波破碎处理后的gDNA溶液经生物分析仪确认片段分布的结果如图2A所示。在图2A中,超声波处理过的DNA在约300 bp以下被检测到片段化。片段化gDNA溶液和非片段化gDNA溶液qPCR的结果比较如图2B所示,可以确认Ct值(Threshold Cycle)无差异。结果表明,本产品在检测片段化gDNA时,检测灵敏度和精度也没有降低,可进行定量和检测。
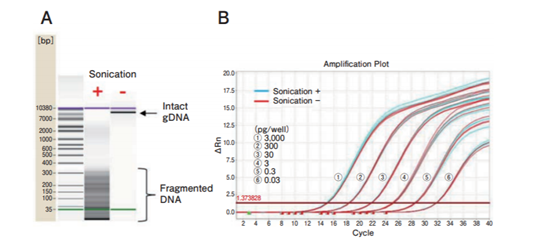
图2. 对片段化DNA检测的qPCR结果,结果可靠
A:片段化gDNA的生物分析仪分析图;B:比较qPCR中gDNA片段化的有无
◆与DNA Extractor® 试剂盒的适配性
DNA Extractor® 试剂盒是一款可在高浓度的蛋白溶液、广pH范围条件内、在生物制剂常用缓冲液和添加剂的存在下高效回收DNA的提取纯化试剂盒5,6,7)。
在抗体模拟溶液(20 mg/mL human IgG溶液)中加入gDNA,使用DNA Extractor® 试剂盒进行纯化,然后使用本产品进行定量加标回收测试。测试结果如下表所示。即使是低DNA量,回收量也达90%以上,数pg水平的DNA量也可稳定检测。
|
DNA添加量 |
0.1 ng/mL |
1 ng/mL |
10 ng/mL |
|
检测系统中的DNA量 |
1 pg |
10 pg |
100 pg |
|
回收率(平均)N=10 |
91.10% |
94.30% |
102.50% |
|
SD |
2.6 |
2.3 |
3.5 |
|
CV% |
2.80% |
2.40% |
3.40% |
表. 高蛋白溶液中的加标回收测试结果
◆结语
如开头所述,对生物制剂的需求和期待在今后也会不断增加。FUJIFILM Wako通过提供简单、高灵敏度、可靠良好的检测系统,致力于为生命科学研究和生物制药产业的发展做出贡献。
◆参考文献
|
1) |
Walsh, G. : Nat. Biotechnol ., 36(12), 1136 (2018). |
|
2) |
WHO Study Group on Biologicals & World Health Organization : "Acceptability of cell substrates for production of biologicals : report of a WHO study group [meeting held in Geneva from 18 to 19 November 1986]", World Health Organization(1987). |
|
3) |
U.S. Food and Drug Administration Center for Biologics Evaluation and Research. : J. Immunother., 20(3), 214(1997). |
|
4) |
Knezevic, I., Stacey, G., Petricciani, J., on behalf of the WHO Study Group on cell substrates : Biologicals, 36(3), 203(2008). |
|
5) |
Cai, H., Gu, X., Scanlan, M. S. and Lively, C. R. : J. Pharm. Biomed. Anal., 55(1), 71(2011). |
|
6) |
Ishizawa, M., Kobayashi, Y., Miyamura, T. and Matsuura, S. : Nucleic Acids Res ., 19 (20), 5792(1991). |
|
7) |
Charlebois, R. L., Sathiamoorthy, S., Logvinoff, C., Gisonni-Lex, L., Mallet, L. and Ng, S. H. S. : NPJ Vaccines, 5(1), 61(2020). |
◆产品列表
|
产品编号 |
产品名称 |
规格 |
包装 |
|
294-85201 |
QCdetect™ Residual DNA Detection Kit for CHO cells |
基因研究用 |
100 tests |
|
290-85301 |
QCdetect™ Residual DNA Detection Kit for E. coli |
基因研究用 |
100 tests |
相关产品
|
产品编号 |
产品名称 |
包装 |
|
292-81101 |
DNA Extractor® Kit for Residual DNA, CP Method(Sodium Iodide Method) 残留DNA提取试剂盒(碘化钠法) |
50 tests |
※ 本页面产品仅供研究用,研究以外不可使用。
